
题目列表(包括答案和解析)
下列实验操作合理的是
A.用25 mL滴定管进行滴定实验时,消耗某溶液体积为21.70 mL
B.在托盘天平的托盘上各垫一张洁净的纸片直接称量NaOH固体
C.用广泛pH试纸测得某溶液的pH为2.3
D.中和滴定实验中的锥形瓶使用前应该用待装液洗涤
(6分)试回答下列问题:
(1)下列实验中所选用的仪器或操作以及结论合理的是____________。
A. 用托盘天平称量5.85 g氯化钠晶体
B. 仅用蒸馏水和pH试纸,就可以鉴别pH相等的H2SO4溶液和CH3COOH溶液
C. 用碱式滴定管量取25.00 mL高锰酸钾溶液
D. 不宜用瓷坩埚灼烧氢氧化钠、碳酸钠
E. 量筒内液体体积读数为10.0 mL时,全部倒入烧杯内的实际体积也是10.0 mL
F. 100 mL容量瓶内液面正好达到刻度线时,全部倒入烧杯内的实际体积也必为100 mL
![]() (2)欲量取15.00 mL Na2CO3溶液,应选用的仪器是_________________。
(2)欲量取15.00 mL Na2CO3溶液,应选用的仪器是_________________。
(3)在硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行___________次。
(4)用已知物质的量浓度的NaOH溶液测定未知物质的量浓度的盐酸,无论是酸往碱中滴还是碱往酸中滴,在其他操作正确规范的前提下,下列操作一定会使测定结果偏高的是____________。
A.酸式滴定管未用待测盐酸润洗 B.碱式滴定管未用标准碱液润洗
C.滴定过程中锥形瓶中不慎有液体溅出 D.滴定前仰视读数,滴定后平视读数
(14分)铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是________________________。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是________;
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
回答下列问题:
①操作Ⅰ的名称是________,操作Ⅱ的名称是________。
②写出在空气中煅烧FeCO3的化学方程式 ;
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O)。
a.称取2.850g绿矾(FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_____________________________________________。
②某同学设计的下列滴定方式,最合理的是________。(夹持部分略去)(填字母序号)
③计算上述样品中FeSO4·7H2O的质量分数为 。
(14分)铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是________________________。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是________;
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
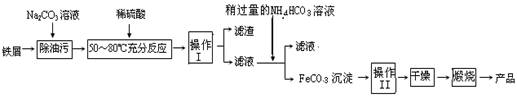
回答下列问题:
①操作Ⅰ的名称是________,操作Ⅱ的名称是________。
②写出在空气中煅烧FeCO3的化学方程式 ;
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O)。
a.称取2.850g绿矾(FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_____________________________________________。
②某同学设计的下列滴定方式,最合理的是________。(夹持部分略去)(填字母序号)
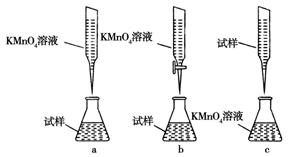
③计算上述样品中FeSO4·7H2O的质量分数为 。
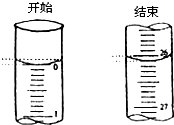 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠 溶液的体积/mL |
0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com