
题目列表(包括答案和解析)
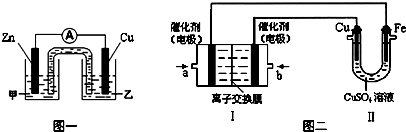
 铜是人类最早使用的金属,被广泛应用于电气、轻工、机械制造和国防工业等.已知Cu2O与H2SO4能发生反应:Cu2O+H2SO4=Cu+CuSO4+H2O.
铜是人类最早使用的金属,被广泛应用于电气、轻工、机械制造和国防工业等.已知Cu2O与H2SO4能发生反应:Cu2O+H2SO4=Cu+CuSO4+H2O.
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 编号 | 信 息 |
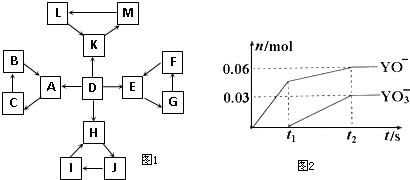
| 1 | D为地壳中含量最高的元素组成的单质 |
| 2 | E为酸性氧化物,不溶于水,能与某种酸反应 |
| 3 | F不溶于水,F用于制备干燥剂以及催化剂的载体 |
| 4 | H为淡黄色固体化合物 |
| 5 | 电解饱和J溶液是工业生产中的重要反应 |
| 6 | C为离子化合物,阴、阳离子均含有金属元素 |
| 7 | K为酸雨的主要成分 |
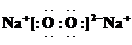
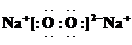
| ||
| ||
硫酸工业生产应考虑综合经济效益问题。
(1)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1 t 98%的硫酸需消耗3.6×105 kJ的热量。请通过计算判断,若反应SO2(g)+![]() O2(g)
O2(g)![]() SO3;ΔH=-98.3 kJ·mol-1放出的热量能在生产过程中得到充分利用,则每生产1 t 98%的硫酸只需外界提供(或可向外界输出)多少千焦热量?(H2SO4的摩尔质量为98 g·mol-1)
SO3;ΔH=-98.3 kJ·mol-1放出的热量能在生产过程中得到充分利用,则每生产1 t 98%的硫酸只需外界提供(或可向外界输出)多少千焦热量?(H2SO4的摩尔质量为98 g·mol-1)
(2)CuFeS2是黄铁矿的另一成分,燃烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为 。
(3)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度的不同而变化(见下表)。
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 矿渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
已知CuSO4在低于660 ℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因 。
(15分)纳米级Cu2 O 粉末,由于量子尺寸效应,其具有特殊的光学、电学及光电化学性质,在太阳电池、传感器、超导体、制氢和电致变色、环境中处理有机污染物等方面有着潜在的应用。
Ⅰ.纳米氧化亚铜的制备
(1)四种制取Cu2O的方法如下:
①火法还原。用炭粉在高温条件下还原CuO;
②最新实验研究用肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。
已知:N2H4(l)+O2(g) N2(g)+2H2O(l)
△H=-a
kJ/mol
N2(g)+2H2O(l)
△H=-a
kJ/mol
Cu(OH)2(s) CuO(s)+H2O(l) △H=b kJ/mol
CuO(s)+H2O(l) △H=b kJ/mol
4CuO(s) 2Cu2O(s)+O2(g)
△H=c
kJ/mol
2Cu2O(s)+O2(g)
△H=c
kJ/mol
则该方法制备Cu2O的热化学方程式为 。
③工业中主要采用电解法:用铜和钛作电极,电解氯化钠和氢氧化钠的混合溶液,电解总方程式为:2Cu+H2O Cu2O+H2↑,则阳极反应式为:
。
Cu2O+H2↑,则阳极反应式为:
。
④还可采用Na2SO3还原CuSO4法:将Na2SO3 和CuSO4加入溶解槽中,制成一定浓度的溶液,通入蒸气加热,于100℃~104℃间反应即可制得。写出该反应的化学方程式: 。
Ⅱ.纳米氧化亚铜的应用
(2)用制得的Cu2O进行催化分解水的实验
①一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入10. 0 mol水蒸气,发生反应:
2H2O(g)  2H2(g)+O2(g)
△H=+484 kJ·mol-1
2H2(g)+O2(g)
△H=+484 kJ·mol-1
T1温度下不同时段产生O2的量见下表:
|
时间/min |
20 |
40 |
60 |
80 |
|
n(O2)/mol |
1.0 |
1.6 |
2.0 |
2.0 |
前20 min的反应速率 v(H2O)= ;该该温度下,反应的平衡常数的表达式K= ;若T2温度下K=0.4,T1 T2(填>、<、=)
②右图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;

③用以上四种方法制得的Cu2O在其它条件相同下分别对水催化分解,产生氢气的速率v随时间t变化如图所示。下列叙述正确的是 。

A.方法③、④制得的Cu2O催化效率相对较高
B.方法④制得的Cu2O作催化剂时,水的平衡转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有
D.Cu2O催化水分解时,需要适宜的温度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com