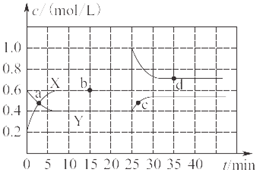
已知NO
2和N
2O
4可以相互转化:2NO
2(g)?N
2O
4(g)△H<0.现将一定量NO
2和N
2O
4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图所示.
(1)图中共有两条曲线X和Y,其中曲线
X
X
表示NO
2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是
bd
bd
.下列不能说明该反应已达到平衡状态的是
B
B
.
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均相对分子质量不随时间变化而改变
(2)①前10min内用NO
2表示的化学反应速率v(NO
2)=
0.04
0.04
mol/(L?min).
②0~15min,反应2NO
2(g)?N
2O
4(g)的平衡常数K(b)=
.
(3)反应25min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是
增大NO2的浓度
增大NO2的浓度
(用文字表达);其平衡常数K(d)
=
=
K(b)(填“>”“=”或“<”).
(4)若要达到使NO
2(g)的百分含量与d点相同的化学平衡状态,在25min时还可以采取的措施是
B、D
B、D
.
A.加入催化剂 B.缩小容器体积
C.升高温度 D.加入一定量的N
2O
4.

 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图所示.
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图所示.