
题目列表(包括答案和解析)
金属和酸、碱、盐的化学性质是初中化学的核心知识,如图,A、B、C、D分别表示上述四类物质中常见的一种,A、B、C、D之间的连线表示它们彼此之间能够发生化学反应,其中A与B能够发生中和反应,D是目前世界上产量最多的金属.
请回答:
(1)C属于 (填“酸”、“碱”或“盐”).
(2)A与D反应产生气体的化学式是 .
(3)实验室可从B和C两类物质中各选一种具体物质作为原料来制取NaOH,写出该反应的化学方程式 .

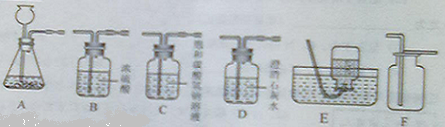
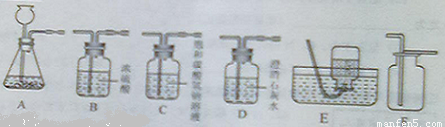
 23、碳酸钠是一种生活中常见的盐,也是一种重要的化工原料.
23、碳酸钠是一种生活中常见的盐,也是一种重要的化工原料.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com