
题目列表(包括答案和解析)
选做题
本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,每题12分。请选择其中一题作答,若两题都作答,则以A题得分计入总分。
20A.过渡元素在生活、生产和科技等方面有广泛的用途。
(1)应用于合成氨反应的催化剂(铁)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则图示铁颗粒表面上氮原子与铁原子的个数比为 。

(2)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是 。(填序号)
A.PFS中铁显+3价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
| 元素 | Mn | Fe | |
| 电离能 (kJ・mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 |
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。现有铬(Ⅲ)与甲基丙烯酸根的配合物为:
①该化合物中存在的化学键类型有 。
②该化合物中一个Cr的配位数为 。
③甲基丙烯酸分子中C原子的杂化方式有 。
④等电子体是具有相同的价电子数和原子数的分子或离子,与H2O分子互为等电子体的微粒是 。(填一种即可)
⑤与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是
____ 。(填元素符号)
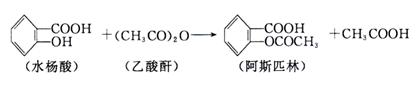 |
在生成乙酰水杨酸的同时,水杨酸分子之间也能发生聚合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
①向150mL干燥锥形瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡,待其溶解后,控制温度在85℃~90℃条件下反应5~10 min,然后冷却,即有乙酰水杨酸晶体析出。
②减压过滤,用滤液淋洗锥形瓶,直至所有晶体收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量将溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。
③将粗产品置于100 mL烧杯中,搅拌并缓慢加入25 mL饱和碳酸氢钠溶液,加完后继续搅拌2~3 min,直到没有二氧化碳气体产生为止。过滤,用5~10 mL蒸馏水洗涤沉淀。合并滤液于烧杯中,不断搅拌,慢慢加入15 mL 4mol / L盐酸,将烧杯置于冰水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1~2次,再抽干水分,即得产品。
(1)第①步中,要控制温度在85℃~90℃,应采用的加热方法是 ,用这种方法加热需要的玻璃仪器有 。
(2)在第②步中,用冷水洗涤晶体,其目的是 、 。
(3)在第③步中,加入饱和碳酸氢钠溶液的作用是 ,加入盐酸的作用是 。
(4)如何检验产品中是否混有水杨酸? 。
选做题
本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,每题12分。请选择其中一题作答,若两题都作答,则以A题得分计入总分。
20A.过渡元素在生活、生产和科技等方面有广泛的用途。
(1)应用于合成氨反应的催化剂(铁)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则图示铁颗粒表面上氮原子与铁原子的个数比为 。

(2)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是 。(填序号)
A.PFS中铁显+3价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
|
元素 |
Mn |
Fe |
|
|
电离能 (kJ・mol-1) |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。现有铬(Ⅲ)与甲基丙烯酸根的配合物为:
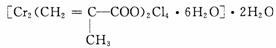
①该化合物中存在的化学键类型有 。
②该化合物中一个Cr的配位数为 。
③甲基丙烯酸分子中C原子的杂化方式有 。
④等电子体是具有相同的价电子数和原子数的分子或离子,与H2O分子互为等电子体的微粒是 。(填一种即可)
⑤与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是
____ 。(填元素符号)
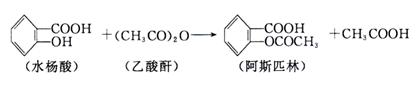 |
在生成乙酰水杨酸的同时,水杨酸分子之间也能发生聚合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
①向150 mL干燥锥形瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡,待其溶解后,控制温度在85℃~90℃条件下反应5~10 min,然后冷却,即有乙酰水杨酸晶体析出。
②减压过滤,用滤液淋洗锥形瓶,直至所有晶体收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量将溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。
③将粗产品置于100 mL烧杯中,搅拌并缓慢加入25 mL饱和碳酸氢钠溶液,加完后继续搅拌2~3 min,直到没有二氧化碳气体产生为止。过滤,用5~10 mL蒸馏水洗涤沉淀。合并滤液于烧杯中,不断搅拌,慢慢加入15 mL 4mol / L盐酸,将烧杯置于冰水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1~2次,再抽干水分,即得产品。
(1)第①步中,要控制温度在85℃~90℃,应采用的加热方法是 ,用这种方法加热需要的玻璃仪器有 。
(2)在第②步中,用冷水洗涤晶体,其目的是 、 。
(3)在第③步中,加入饱和碳酸氢钠溶液的作用是 ,加入盐酸的作用是 。
(4)如何检验产品中是否混有水杨酸? 。
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中—题,并在相应的答题区域作答。若两题都做,则按A题评分。
A.镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)请参考下述数据填空和回答问题:
工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。不用电解MgO的方法生产镁的原因 ;不用电解AlCl3的方法生产铝的原因 。
(2)2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如图所示。镁原子间形成正六棱柱,六个硼原子位于棱柱内。则该化合物的化学式可表示为 。
(3)写出Cu+的核外电子排布式 。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。
(5)某喹喏酮类药物(中心离子是Cu2+)结构如下图,关于该药物的说法正确的是 。
A.中心离子Cu2+的配位数是5
B.N原子均采用sp2杂化
C.存在配位键、极性共价键和非极性共价键
D.熔点很高,硬度很大
B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤I:称取0.4 g花生油样品,置于两个干燥的碘瓶(如图)内,加入10 mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00 mL含0.01 mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。
步骤II:在暗处放置30 min,并不时轻轻摇动。30 min后,小心地打开玻璃塞,用新配制的10%
碘化钾10 mL和蒸馏水50 mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1 mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
①
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是 ,碘瓶不干燥会发生反应的化学方程式 。
(2)步骤Ⅱ中碘瓶在暗处放置30 min,并不时轻轻摇动的原因是 。
(3)步骤Ⅲ中所加指示剂为 ,滴定终点的现象 。
(4)反应结束后从液体混合物中回收四氯化碳,所需操作有 。
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中—题,并在相应的答题区域作答。若两题都做,则按A题评分。
A.镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)请参考下述数据填空和回答问题: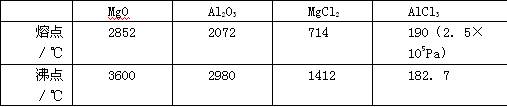
工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。不用电解MgO的方法生产镁的原因 ;不用电解AlCl3的方法生产铝的原因 。
(2)2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如图所示。镁原子间形成正六棱柱,六个硼原子位于棱柱内。则该化合物的化学式可表示为 。
(3)写出Cu+的核外电子排布式 。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。
(5)某喹喏酮类药物(中心离子是Cu2+)结构如下图,关于该药物的说法正确的是 。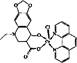
A.中心离子Cu2+的配位数是5
B.N原子均采用sp2杂化
C.存在配位键、极性共价键和非极性共价键
D.熔点很高,硬度很大
B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤I:称取0.4 g花生油样品,置于两个干燥的碘瓶(如图)内,加入10 mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00 mL含0.01 mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。
步骤II:在暗处放置30 min,并不时轻轻摇动。30 min后,小心地打开玻璃塞,用新配制的10%
碘化钾10 mL和蒸馏水50 mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1 mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
①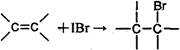
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是 ,碘瓶不干燥会发生反应的化学方程式 。
(2)步骤Ⅱ中碘瓶在暗处放置30 min,并不时轻轻摇动的原因是 。
(3)步骤Ⅲ中所加指示剂为 ,滴定终点的现象 。
(4)反应结束后从液体混合物中回收四氯化碳,所需操作有 。
(12分)[选做题]本题包括A、B两小题,分别对应于 “物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.铁是地壳中含量较丰富的元素,仅次于氧、硅、铝元素,其单质及合金是在生产生活中应用广泛的金属材料。化学上常用KSCN溶液等来检验溶液中是否存在Fe3+。
(1)Fe3+离子基态的电子排布式可表示为 。
(2)一种铁晶体的晶胞属于体心立方堆积,则该晶胞中所包括的铁原子的个数是 。
(3)C、N两种元素的简单气态氢化物的热稳定性由强到弱的顺序为 。
(填化学式)
(4)C、N、O三种元素的第一电离能由大到小的顺序为 。(填元素符号)
(5)离子化合物Fe2O3的熔点高于KC1的熔点的原因是 。
(6)据报道:由Q、X、Z三种元素形成的一种晶体具有超导性,其晶体结构如右图所示。晶体中距每个X原子周围距离最近的Q的原子的个数是 。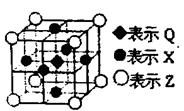
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com