
题目列表(包括答案和解析)
某实验小组用氨碱法制取碳酸钠的原理,在实验室设计下列模拟装置制备NaHCO3(铁架台、C装置水浴中的温度计、酒精灯等略去),然后再制取Na2CO3。提供的试剂有:硫酸、盐酸、石灰石、浓氨水、碳酸氢钾溶液、水、生石灰、食盐等。


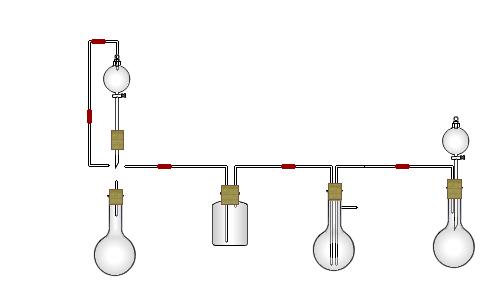
(1)在A中分液漏斗和烧瓶中加入的试剂分别是 、 ;D中分液漏斗和烧瓶中加入的试剂分别为 、 ;
(2) B中加入的试剂是 , 作用是 。
(3)写出C中生成的NaHCO3化学方程式: 。
(4)装置A中分液漏斗上方装一导管的主要作用是 。
(5)实验开始a、b两活塞的正确操作应是(选填序号) 。
①同时打开a、b两活塞 ②先打开a,后打开b ③先打开b,后打开a
(6)检验C装置溶液中生成的溶质是NaHCO3而不是Na2CO3的方法是 。
(7)由C中NaHCO3再制取Na2CO3需进行的实验操作有过滤、洗涤、 。
(8)从绿色化学角度看,这一装置的主要缺点是尾气逸出,浪费资源,
|
某实验小组用氨碱法制取碳酸钠的原理,在实验室设计下列模拟装置制备NaHCO3(铁架台、C装置水浴中的温度计、酒精灯等略去),然后再制取Na2CO3。提供的试剂有:硫酸、盐酸、石灰石、浓氨水、碳酸氢钾溶液、水、生石灰、食盐等。

(1)在A中分液漏斗和烧瓶中加入的试剂分别是 、 ;D中分液漏斗和烧瓶中加入的试剂分别为 、 ;
(2) B中加入的试剂是 , 作用是 。
(3)写出C中生成的NaHCO3化学方程式: 。
(4)装置A中分液漏斗上方装一导管的主要作用是 。
(5)实验开始a、b两活塞的正确操作应是(选填序号) 。
①同时打开a、b两活塞 ②先打开a,后打开b ③先打开b,后打开a
(6)检验C装置溶液中生成的溶质是NaHCO3而不是Na2CO3的方法是 。
(7)由C中NaHCO3再制取Na2CO3需进行的实验操作有过滤、洗涤、 。
(8)从绿色化学角度看,这一装置的主要缺点是尾气逸出,浪费资源,
|

(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是________ (填标号)。
A.碳酸氢钠难溶于水?
B.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出?
C.碳酸氢钠受热易分解?
(2)某探究活动小组根据工业制取碳酸钠的原理,进行碳酸氢钠的制备实验, 同学们按各自设计的方案实验。?
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。?
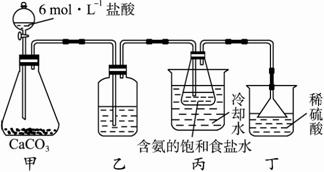
i.乙装置中的试剂是_______________(填标号)。?
A.烧碱溶液?
B.澄清石灰水?
C.浓氨水?
D.蒸馏水?
ii.丁装置的作用是_________________________。?
iii.实验结束后,分离出NaHCO3晶体的操作是_________________(填名称)。
②另一位同学用下图中戊装置(其他装置未画出)进行实验。
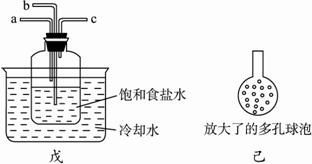
i.实验时,须先从a管通入_________气体,再从b管通入____________气体。?
ii.有同学建议在b管下端连接上图中己装置,理由是__________________________。?
(3)请你再写出一种实验室制取少量碳酸氢钠的方法。____________________________。
| ||
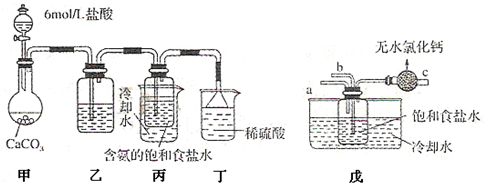
工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体。该反应原理可以用以下化学方程式表示,此反应是放热反应。
NH3 + CO2 + H2O + NaCl(饱和) ![]() NaHCO3(晶体)↓+ NH4Cl
NaHCO3(晶体)↓+ NH4Cl
(1)某校学生实验小组利用上述反应原理,设计如图所示装置,制取碳酸氢钠晶体。C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
可选用的药品有:a.石灰石 b.生石灰 c.6 mol/L盐酸 d.稀硫酸 e.浓氨水
f.饱和氯化钠溶液。

①A中制备气体时,所需药品是(选填字母代号) ;
②B中盛有饱和碳酸氢钠溶液,其作用是 ;
③在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式为 ;
④检验D出口处是否有氨气逸出的方法是 。
(2)该小组同学为了测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为wg。再将晶体加热到质量不再变化时,称量所得粉末质量为mg。然后进行如图所示实验:

①在操作II中,为了判断加入氯化钙溶液是否过量,其中正确的是(选填字母序号) ;
A.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
B.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
C.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②操作III的方法为 、 、 ;
③所得晶体中碳酸氢钠的纯度为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com