
题目列表(包括答案和解析)
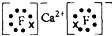
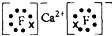

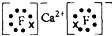
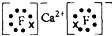
| ||
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和![]() ,并含有3.5%(质量分数)
,并含有3.5%(质量分数)![]() .
.
(1)![]() 元素在周期表中位置是 ,其原子结构示意图 .
元素在周期表中位置是 ,其原子结构示意图 .
(2)![]() 与最活跃的非金属元素A形成化合物D,D的电子式为 ,D的沸点比A与
与最活跃的非金属元素A形成化合物D,D的电子式为 ,D的沸点比A与![]() 形成的化合物E的沸点 .
形成的化合物E的沸点 .
(3)配平用钙线氧脱鳞的化学方程式:
□P+□FeO+□CaO![]()
![]() □
□![]() +□Fe
+□Fe
(4)将钙线试样溶于稀盐酸后,加入过量![]() 溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色
溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色![]() .则金属M为______;检测
.则金属M为______;检测![]() 的方法是_____(用离子方程式表达).
的方法是_____(用离子方程式表达).
(5)取1.6g钙线试样,与水充分反映,生成224ml.![]() (标准状况),在想溶液中通入适量的
(标准状况),在想溶液中通入适量的![]() ,最多能得到
,最多能得到![]() g.
g.
(9分)金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和![]() ,并含有3.5%(质量分数)
,并含有3.5%(质量分数)![]() 。
。
(1)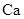 元素在周期表中位置是 ,其原子结构示意图 ;
元素在周期表中位置是 ,其原子结构示意图 ;
(2)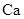 与最活跃的非金属元素A形成化合物D,D的电子式为 ;
与最活跃的非金属元素A形成化合物D,D的电子式为 ;
![]() (3)配平用钙线氧脱鳞的化学方程式:
(3)配平用钙线氧脱鳞的化学方程式:
P + FeO+ CaO == Ca3(PO4)2+ Fe;
(4)将钙线试样溶于稀盐酸,加入过量![]() 溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则检测
溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则检测![]() 的方法是 (用离子方程式表达);
的方法是 (用离子方程式表达);
(5)取1.6g钙线试样,与水充分反映,生成224ml.H2(标准状况),在向溶液中通入适量的CO2,最多能得到CaCO3 g。
(11分)金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca。
(1)Ca的原子结构示意图 。
(2)配平用钙线氧脱鳞的化学方程式:
P + FeO+ CaO Ca3(PO4)2+ Fe
(3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n。则金属M为_________,检测Mn+ 的方法是_____________________(用离子方程式表达)。
(4)取1.6g钙线试样,与水充分反应,生成224ml H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3 g。
(5)处理炼钢厂含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知:CO(g) + 1/2 O2(g)== CO2(g) ![]() H = -283.0kJ·mol-2
H = -283.0kJ·mol-2
S(s) + O2(g) ==YO2(g) ![]() H = -296.0kJ·mol-1
H = -296.0kJ·mol-1
此反应的热化学方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com