
题目列表(包括答案和解析)
 干燥剂“碱石灰”是氧化钙和氢氧化钠的混合物,在空气中容易变质.某研究小组对一只干燥管里的“碱石灰”样品的成分进行实验探究.
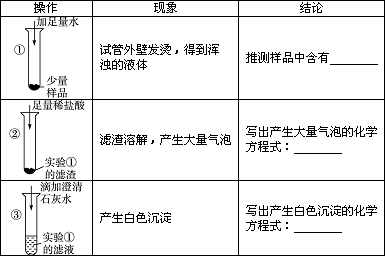
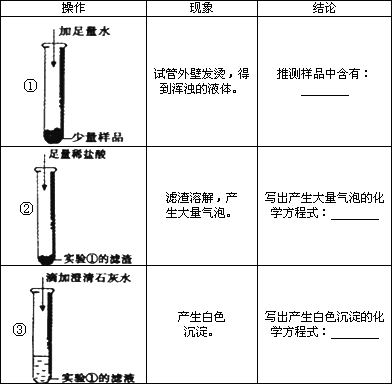
干燥剂“碱石灰”是氧化钙和氢氧化钠的混合物,在空气中容易变质.某研究小组对一只干燥管里的“碱石灰”样品的成分进行实验探究.| 操作 | 现象 | 结论 |
① |
试管外壁发烫,得到浑浊的液体 | 推测样品中含有 氧化钙和氢氧化钠至少有一个 氧化钙和氢氧化钠至少有一个 |
②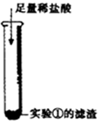 |
滤渣溶解,产生大量气泡 | 写出产生大量气泡的化学方程式 CaCO3+2HCl=CaCl2+H2O+CO2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ |
③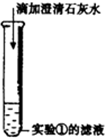 |
产生白色沉淀 | 写出产生白色沉淀的化学方程式 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH Ca(OH)2+Na2CO3=CaCO3↓+2NaOH |
| 操作 | 现象 | 结论 |
① | 试管外壁发烫,得到浑浊的液体 | 推测样品中含有______ |
②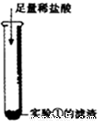 | 滤渣溶解,产生大量气泡 | 写出产生大量气泡的化学方程式______ |
③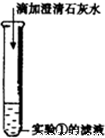 | 产生白色沉淀 | 写出产生白色沉淀的化学方程式______ |
干燥剂“碱石灰”是氧化钙和氢氧化钠的混合物,在空气中容易变质.某研究小组对一只干燥管里的“碱石灰”样品的成分进行实验探究.

[提出猜想]
猜想Ⅰ:没有变质,只含有氧化钙和氢氧化钠.
猜想Ⅱ:部分变质,含有……
猜想Ⅲ:完全变质,只含有碳酸钙、碳酸钠.
[实验探究]
[小结与思考]
(1)从上述实验现象推断:猜想________成立.
(2)“碱石灰”样品里是否一定含有碳酸钙?请说明理由.
________.
干燥剂“碱石灰”是氧化钙和氢氧化钠的混合物,在空气中容易变质.某研究小组对一只干燥管里的“碱石灰”样品的成分进行实验探究.

[提出猜想]
猜想Ⅰ:没有变质,只含有氧化钙和氢氧化钠.
猜想Ⅱ:部分变质,含有……
猜想Ⅲ:完全变质,只含有碳酸钙、碳酸钠.
[实验探究]
[小结与思考]
(1)从上述实验现象推断:猜想________成立.
(2)“碱石灰”样品里是否一定含有碳酸钙?请说明理由.
___________________.
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量样品置于试管中,加足量的水溶解,观察并用手触摸试管外壁 | 形成浊液 试管外壁发热 |
则样品中CaO 和 Ca(OH)2、CaCO3 Ca(OH)2、CaCO3 至少有一种 |
| ②将①的浊液过滤,向所得的滤液中逐滴加入氯化钙溶液至过量 | 产生白色沉淀 |
样品中含有的物质是 Na2CO3 Na2CO3 |
| ③将②的浊液过滤,向所得的滤液中滴加几滴酚酞溶液 | 溶液 变成红色 变成红色 |
由步骤①可知:最后滤液一定显碱性, 因此无法检验样品中的Ca(OH)2 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com