
题目列表(包括答案和解析)
(1)铝元素在周期表中处于____________(填周期数、主族数);Al3+的结构示意图为____________。
(2)无机富锌涂料在防止钢铁腐蚀的过程中,锌电极上的电极反应为,掺入少量铝粉的无机富锌涂料能使钢铁抗腐蚀能力增强的可能原因之一是________________________。
(3)铝热反应在冶炼金属及定向爆破等实际应用中有着重要的用途。铝和氧化铁在高温条件下反应,当转移3 mol电子时,产生铁的质量是____________g。
(4)铝铵矾[NH4Al(SO4)2·12H2O]是一种重要的复盐,当向铝铵矾稀溶液中逐滴加入0.1 mol·L-1NaOH溶液出现了如下a、b、c三个阶段的图象
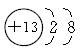
根据上图完成下列离子反应方程式:
b阶段:________________________________________________;
c阶段:________________________________________________。
水溶性无机富锌涂料对防止钢铁腐蚀具有重要作用,研究表明无机富锌涂料中掺入少量铝粉可延长钢铁的抗腐蚀年限。请回答下列问题。
(1)铝元素在周期表中处于 (填周期数、主族数);Al3+的结构示意图为 。
(2)无机富锌涂料在防止钢铁腐蚀的过程中,锌电极上的电极反应为 ,掺入少量铝粉的无机富锌涂料能使钢铁抗腐蚀能力增强的可能原因之一是
。
(3)铝热反应在冶炼金属及定向爆破等实际应用中有着重要的用途。铝和氧化铁在高温条件下反应,当转移3mol电子时,产生铁的质量是 g。
(4)铝铵矾[NH4Al(SO4)2?12H2O]是一种重要的复盐,当向铝铵矾稀溶液中逐滴加入0.1mol?L-1 NaOH溶液出现了如下a、b、c三个阶段的图象
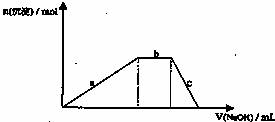
根据上图完成下列离子反应方程式:
b阶段: ;
c阶段: 。
铝、铁和氯是三种运用广泛的元素.
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式________,若将此反应设计成原电池,写出电极反应式:正极反应________,负极反应________.
(2)工业上用电解饱和食盐水的方法制取氯气,制得的氯气与另一电解产物在一定条件下反应生成两种盐A和B,其物质的量比为5∶1,则盐A和B的化学式依次为________,盐B在酸性条件下可与草酸(H2C2O4)反应制得气体ClO2,写出该反应的离子方程式:________,ClO2是当前对饮用水进行消毒的一种高效消毒剂,物质的量相等的ClO2和Cl2相比较,ClO2的消毒杀菌能力是Cl2的________倍.
(3)生产中常用铝热反应焊接钢轨,反应的化学方程式为________;同温同压下,在浓度均为2 mol/L,体积均为100 mL的盐酸和NaOH溶液中分别加入等质量的铝,产生气体的体积比为5∶6,则加入铝的质量为________g.
|
铍(Be)与铝的性质相似,已知反应BeCl2+Na2[Ba(OH)4] | |
| [ ] | |
A. |
常温时,BeCl2溶液pH>7,将其蒸干、灼烧后可得残留物BeCl2 |
B. |
常温时,Na2[Ba(OH)4]溶液pH<7,将其蒸干、灼烧后可得残留物Na2[Be(OH)4] |
C. |
Be(OH)2既能溶于盐酸,又能溶于NaOH溶液 |
D. |
BeCl2水溶液的导电性较强,说明BeCl2一定是离子化合物 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com