氮可以形成多种化合物,如NH
3、N
2H
4、HCN、NH
4NO
3等.
(1)已知:N
2(g)+2H
2(g)═N
2H
4(l);△H=+50.6kJ?mol
-12H
2(g)+O
2(g)═2H
2O(l);△H=-571.6kJ?mol
-1①N
2H
4(l)+O
2(g)═N
2(g)+2H
2O(l);△H=
-622.2
-622.2
kJ?mol
-1.
②N
2(g)+2H
2(g)═N
2H
4(l)不能自发进行的原因是
△H>0,△S<0
△H>0,△S<0
.
③用次氯酸钠氧化氨气,可以得到N
2H
4的稀溶液,该反应的化学方程式是
NaClO+2NH3═N2H4+NaCl+H2O
NaClO+2NH3═N2H4+NaCl+H2O
.
(2)采矿废液中的CN
-可用H
2O
2处理.已知:H
2SO
4═H
++HSO
;HSO
??H
++SO
.用铂电极电解硫酸氢钾溶液,在阳极上生成S
2O
,S
2O
水解可以得到H
2O
2.写出阳极上的电极反应式:
2HSO4--2e-═S2O82-+2H+
2HSO4--2e-═S2O82-+2H+
.
(3)氧化镁处理含NH
的废水会发生如下反应:
MgO+H
2O?Mg(OH)
2;
Mg(OH)
2+2NH
?Mg
2++2NH
3?H
2O.
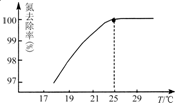
①温度对氮处理率的影响如图所示.在25℃前,升高温度氮去除率增大的原因是
升高温度NH3的溶解度降低,有利于NH3的逸出
升高温度NH3的溶解度降低,有利于NH3的逸出
.
②剩余的氧化镁,不会对废水形成二次污染,理由是
氧化镁难溶于水中,以沉淀的形式排出,因此不会形成二次污染
氧化镁难溶于水中,以沉淀的形式排出,因此不会形成二次污染
.
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下:①取10mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175mL;②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热;③用25mL硼酸吸收蒸馏出的氨[2NH
3+4H
3BO
3═(NH
4)
2B
4O
7+5H
2O];④将吸收液移至锥形瓶中,加入2滴指示剂,用c mol?L
-1的硫酸滴定至终点[(NH
4)
2B
4O
7+H
2SO
4+5H
2O═(NH
4)
2SO
4+4H
3BO
3],记录消耗的体积V mL.则水样中氮的含量是
2 800cV
2 800cV
mg?L
-1(用含c、V的表达式表示).

 氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.