
题目列表(包括答案和解析)
| A.饱和碳酸钠溶液 | B.紫色石蕊试液 |
| C.稀盐酸 | D.硝酸镁溶液 |
| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置. | 没有白色沉淀,溶液呈红色 | 猜想2正确 |
有白色沉淀,溶液由红色变为无色 有白色沉淀,溶液由红色变为无色 |
猜想1正确 | |
有白色沉淀,溶液呈红色 有白色沉淀,溶液呈红色 |
猜想3正确 |
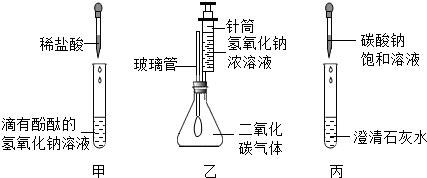
 (2013?川汇区三模)酸、碱、盐和氧化物的知识是初中化学重要的基础知识,以下是同学们对相关知识进行探究的过程.
(2013?川汇区三模)酸、碱、盐和氧化物的知识是初中化学重要的基础知识,以下是同学们对相关知识进行探究的过程.| 未加稀盐酸时 | 第一次加入10.0g稀盐酸 | 第二次加入10.0g稀盐酸 | 第三次加入10.0g稀盐酸 | 第四次加入10.0g稀盐酸 | |
| 烧杯中物质总质量 | 10.0g | 18.9g | 27.8g | 36.7g | 46.7g |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com