
题目列表(包括答案和解析)
海洋资源十分丰富。
(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、过滤、 可制得精盐。
上述过程所用的主要玻璃仪器有:a烧杯、b玻璃棒、c 、d 。
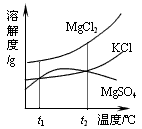
(2)晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,
右图是它们的溶解度曲线示意图。
设t1℃时MgCl2、KCl和MgSO4三种物质的溶解度分别
为a、b、c,则它们的大小关系为 。
(3)目前世界上60%的镁是从海水中提取的。其主要步骤如下:
①提取Mg的过程中,试剂A可以选用 ,试剂B选用 ,
由无水MgCl2制取Mg的化学反应方程式为 。
②镁是重要的金属材料,广泛应用于合金、火箭和飞机制造业,世界上大部分镁是从海水中提取的。某校学习小组的同学对家乡附近海水中镁元素的含量进行测定。称取海水100kg,然后再加入足量的试剂A,过滤、洗涤、干燥后称量得到沉淀质量见下表(重复实验三次)。
| 实验序号 | 第一次实验 | 第二次实验 | 第三次实验 |
| 所取海水质量/kg | 100 | 100 | 100 |
| 生成沉淀质量/kg | 0.28 | 0.29 | 0.30 |
试计算海水中镁元素的质量分数 。
③分离出Mg(OH)2后的NaCl溶液中还含有杂质CaCl2、Na2SO4,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液和Na2CO3溶液,过滤,再向滤液中加入适量盐酸。实验中加入过量BaCl2溶液是为了除去 ;加入过量Na2CO3溶液的目的是 。
(4)目前海水淡化普遍采用“多级闪急蒸馏法”,证明蒸馏得到的水为淡水的方法是
。海底矿产资源“可燃冰”,其主要成分是水合甲烷晶体(CH4·nH2O),若水合甲烷晶体中CH4的质量分数为10%,则水合甲烷晶体的化学式为


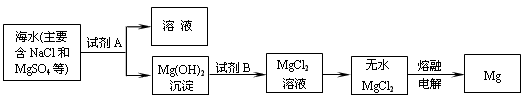

我国有较长的海岸线,海洋资源十分丰富。以下是对海水资源的部分利用。
(1)海水中含量最高的盐是 ,海水经 结晶可获得粗盐。
工业上采用如下的流程从海水中提取精盐:
 |
上述流程中Ⅰ、Ⅱ、Ⅲ分别是 、 、 。
(2) 粗盐中含有泥沙、硫酸镁、氯化钙等杂质。将粗盐溶于水,然后再进行如下操作即可得到较纯的氯化钠:①过滤;②加过量的NaOH溶液;③加适量的盐酸;④加过量的Na2CO3溶液;⑤加过量的BaCl2溶液。正确的操作顺序是 。
(3)从“晒盐”后的母液(卤水)中提取重要金属镁。提取镁的步骤如下:
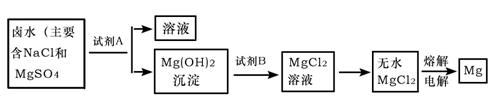
提取Mg的过程中,试剂A最好选用 ,试剂B选用 。电解无水MgCl2的过程中 能转化为 能。
(5分)我国有较长的海岸线,海洋资源十分丰富。以下是对海水资源的部分利用。
(1)海水中含量最高的盐是 ,海水经 结晶可获得粗盐。
(2)粗盐中含有泥沙、硫酸镁、氯化钙等杂质。将粗盐溶于水,然后再进行如下操作即可得到较纯的氯化钠:①过滤;②加过量的NaOH溶液;③加适量的盐酸;④加过量的Na2CO3溶液;⑤加过量的BaCl2溶液。正确的操作顺序是 。
A ①②⑤④③ B ①⑤②④③ C ②④⑤①③ D ⑤②④①③
(3)从晒盐后的卤水中提取重要金属镁。提取镁的步骤如下:
 |
(5分)我国有较长的海岸线,海洋资源十分丰富。以下是对海水资源的部分利用。
(1)海水中含量最高的盐是 ,海水经 结晶可获得粗盐。
(2)粗盐中含有泥沙、硫酸镁、氯化钙等杂质。将粗盐溶于水,然后再进行如下操作即可得到较纯的氯化钠:①过滤;②加过量的NaOH溶液;③加适量的盐酸;④加过量的Na2CO3溶液;⑤加过量的BaCl2溶液。正确的操作顺序是 。
A ①②⑤④③ B ①⑤②④③ C ②④⑤①③ D ⑤②④①③
(3)从晒盐后的卤水中提取重要金属镁。提取镁的步骤如下:

 |
提取Mg的过程中,试剂A最好选用 (从我国有丰富的石灰石资源考虑),试剂B选用 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com