
题目列表(包括答案和解析)
| 实验操作和步骤 | 实验现象与结论 |
| (1)用四只试管,各取少量四种溶液,分别滴加紫色石蕊试液 | 一只试管中溶液由无色变红色,则原溶液是 稀盐酸 稀盐酸 溶液 |
| (2)另用三只试管,各取少量未确定的三种溶液,分别滴加步骤(1)检验出的溶液 | 一只试管溶液中有气泡放出,则原溶液是 碳酸钠 碳酸钠 溶液 |
| (3)另用两只试管, 各取少量未确定两种溶液 各取少量未确定两种溶液 分别滴加(2)中检测出的溶液 分别滴加(2)中检测出的溶液 |
一只试管溶液中有白色沉淀析出,则溶液是 氢氧化钙 氢氧化钙 溶液,反应的化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH Na2CO3+Ca(OH)2=CaCO3↓+2NaOH ,另一只试管溶液中无现象,则原溶液是氢氧化钠 氢氧化钠 溶液 |
| 实验操作和步骤 | 实验现象与结论 |
| (1)用4支试管,各取少量四种溶液,分别滴加紫色石蕊试液. | 一支试管中溶液由无色变红色,则原溶液是 HCl 溶液. |
| (2)另用3支试管,各取少量未确定的三种溶液,分别滴加步骤(1)检验出的溶液. | 一支试管溶液中有气泡放出,则原溶液是 Na2CO3 溶液. |
| (3)另用2支试管, 各取少量未确定两种溶液, ,分别滴加(2)中检测出的溶液 . |
一支试管溶液中有白色沉淀析出,则原溶液是 Ca(OH)2 溶液,反应的化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH ,另一支试管溶液中无现象. |
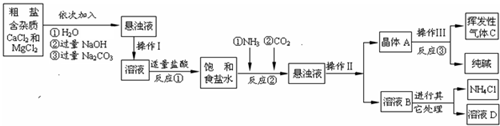
| ||
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
| 实验一 | 实验二 | 实验三 | 实验四 | |
| 固体混合物溶液质量 | 100g | 100g | 100g | 100g |
| 加入CaCl2溶液质量 | 10g | 20g | 30g | 40g |
| 生成的沉淀的质量 | 4g | m | 10g | 10g |
| 工业纯碱标准:(Na2CO3% ) | |||
| 优等品 | 一等品 | 合格品 | 次品 |
| ≥95 | ≥80 | ≥75 | ≤40 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com