
题目列表(包括答案和解析)
银镜反应是检验醛基的重要反应,教材对该实验的操作条件只是粗略的描述。某同学进行如下研究:
(1)在干净试管中加入2ml2% ,然后, 得到银氨溶液,分装入5支试管,编号为1#.2#.3#.4#.5# 。
(2)依次滴加2%.5%.10%.20%.40%的乙醛溶液4滴,快速振荡后置于60℃~70℃的水浴中。3分钟后,试管1#未形成大面积银镜,试管5# 的银镜质量差有黑斑, 试管4# 产生的银镜质量一般,试管2#.3# 形成光亮的银镜。
该研究的目的是: 。
(3)乙醛发生银镜反应的化学方程式为: ,
(4)有文献记载:在强碱性条件下,加热银氨溶液可能析出银镜。验证和对比实验如下。
|
装置 |
实验序号 |
试管中的药品 |
现象 |
|
|
实验Ⅰ |
2mL银氨溶液和数滴较浓NaOH溶液 |
有气泡产生: 一段时间后,溶液逐渐变黑:试管壁附着银镜 |
|
实验Ⅱ |
2mL银氨溶液和 数滴浓氨水 |
有气泡产生:一段时间后,溶液无明显变化 |
该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料后,得知:
a.Ag(NH3)2++2H2O Ag++2NH3·H2O b.AgOH不稳定,极易分解为黑色Ag2O
Ag++2NH3·H2O b.AgOH不稳定,极易分解为黑色Ag2O
经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O。产生Ag2O的原因是:
。
(5)用湿润的红色石蕊试纸检验NH3产生的现象是 。用稀HNO3清 洗试管壁上的Ag,该反应的化学方程式是 。
(6)该同学对产生银镜的原因提出假设:在NaOH存在下,可能是NH3还原Ag2O。如果该假设成立,则说明检验醛基时,银氨溶液不能呈强碱性,因为:
银镜反应是检验醛基的重要反应,教材对该实验的操作条件只是粗略的描述。某同学进行如下研究:
(1)在干净试管中加入2ml2% ,然后, 得到银氨溶液,分装入5支试管,编号为1#.2#.3#.4#.5# 。
(2)依次滴加2%.5%.10%.20%.40%的乙醛溶液4滴,快速振荡后置于60℃~70℃的水浴中。3分钟后,试管1#未形成大面积银镜,试管5# 的银镜质量差有黑斑, 试管4# 产生的银镜质量一般,试管2#.3# 形成光亮的银镜。
该研究的目的是: 。
(3)乙醛发生银镜反应的化学方程式为: ,
(4)有文献记载:在强碱性条件下,加热银氨溶液可能析出银镜。验证和对比实验如下。
| 装置 | 实验序号 | 试管中的药品 | 现象 |
 | 实验Ⅰ | 2mL银氨溶液和数滴较浓NaOH溶液 | 有气泡产生: 一段时间后,溶液逐渐变黑:试管壁附着银镜 |
| 实验Ⅱ | 2mL银氨溶液和 数滴浓氨水 | 有气泡产生:一段时间后,溶液无明显变化 |
 Ag++2NH3·H2O b.AgOH不稳定,极易分解为黑色Ag2O
Ag++2NH3·H2O b.AgOH不稳定,极易分解为黑色Ag2O| 装置 | 实验序号 | 试管中的药品 | 现象 |
 | 实验Ⅰ | 2mL银氨溶液和数滴较浓NaOH溶液 | 有气泡产生: 一段时间后,溶液逐渐变黑:试管壁附着银镜 |
| 实验Ⅱ | 2mL银氨溶液和 数滴浓氨水 | 有气泡产生:一段时间后,溶液无明显变化 |
 Ag++2NH3·H2O b.AgOH不稳定,极易分解为黑色Ag2O
Ag++2NH3·H2O b.AgOH不稳定,极易分解为黑色Ag2OI.设反应①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
|
T(K) |
K1 |
K2 |
|
973 |
1.47 |
2.36 |
|
1173 |
2.15 |
1.67 |
(1)现有反应③CO2(g)+H2(g)  CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有
(填序号)。
CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有
(填序号)。
A.缩小反应容器容积
B.扩大反应容器容积
C.降低温度
D.升高温度
E.使用合适的催化剂
F.设法减少CO的量
(2)若反应Fe(s)+CO2(g)  FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
 FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)。
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)。
A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)钢铁的表面发蓝、发黑处理是常用的防腐方法。请配平主要反应的方程式:
□Na2FeO2+□NaNO2+□H2O=□NaFeO2+□NH3↑+□NaOH
(2)钢铁经冷、浓HNO3处理后“钝化”能达到防腐目的,不同浓度的HNO3与铁反应的还原产物很复杂,其分布曲线如图。
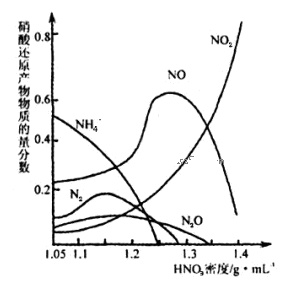
①图示可知,分析HNO3与铁反应的规律是 。
②工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是 。
(3)金属(M)的腐蚀是因为发生反应:M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是 (填字母编号)
A.在铁中掺入铬等金属制成不锈钢
B.在铁制品表面镀锌
C.提高铁中含碳量,制成生铁
D.将水库铁闸门与直流电源的负极相连
I.根据反应3Cu+8HNO3 3Cu(NO3)2+2NO↑+4H2O,回答下列问题:
(1)氧化剂是 , 元素被氧化;
(2)用“双线桥”表示该反应电子转移的方向和数目:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(3)当有2 mol HNO3被还原时,被氧化的物质的质量为 ,转移的电子数为 ;
II. 有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请将这6种物质组成一个化学方程式(需配平):
2002年9月26日,中国北京曙光公司研制出了第一款具有我国完全自主知识产权的高性能CPU 芯片— “龙芯”1号。该芯片中主要成分可以制成计算机长距离联网传输的线路材料,这种埋在地下的材 料如果裸露在碱性土壤中,结果会断路,用离子方程式说明原因
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com