
题目列表(包括答案和解析)
25℃时,在0.01mol·L-1的硫酸溶液中,水电离出的c(H+)是( )
A.5×10-13mol·L-1 B.0.02mol·L-1 C.1×10-7mol·L-1 D.1×10-12mol·L-1
25℃时,在0.01mol·L-1的硫酸溶液中,水电离出的c(H+)是( )
A.5×10-13mol·L-1 B.0.02mol·L-1 C.1×10-7mol·L-1 D.1×10-12mol·L-1
25℃时,在0.01mol·L-1的硫酸溶液中,水电离出的c(H+)是( )
A.5×10-13mol·L-1 B.0.02mol·L-1 C.1×10-7mol·L-1 D.1×10-12mol·L-1
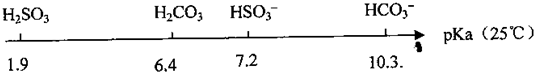
(11分)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32- +2H+ = I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:[来源:学&科&网]
|
|
0.01mol·L-1KIO3酸性溶液(含淀粉)的体积/mL |
0.01mol·L-1 Na2SO3溶液的体积/mL |
H2O的体积/mL |
实验温度 /℃ |
溶液出现蓝色时所需时间/s |
|
实验1 |
5 |
V1 |
35 |
25 |
t 1 |
|
实验2 |
5 |
5 |
40 |
25 |
t 2 |
|
实验3 |
5 |
5 |
V2 |
0 |
t 3[来源:] |
(1) 碘酸钾与亚硫酸钠的反应是 ___________________(填反应类型);
(2)该实验的目的是①____________________________________________,
②_____________________________________________________________;
(3)表中V2=___________mL, V1=___________mL
(4)t1_______ t2_________t3(填“<”、“>”或“=”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com