
题目列表(包括答案和解析)
|
氧化还原反应的本质是: | |
| [ ] | |
A. |
元素化合价发生变化 |
B. |
反应中有氧原子的得失 |
C. |
反应后生成新的物质 |
D. |
反应中有电子得失或电子对的偏移 |
过氧化氢(H2O2,O的化合价为-1价)俗称双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。研究下列涉及H2O2的反应,完成下列各题:
A.Ag2O+ H2O2=2Ag+O2 ↑ + H2O
B.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)写出一个H2O2既体现氧化性又体现还原性的化学反应方程式 。
(2)将下列物质:H2O2、K2SO4、MnSO4、H2SO4、KMnO4、O2的化学式分别填在空白处组成一个不需配平的化学方程式: + +______ → + + + H2O
①该反应中的还原剂是 。
②该反应中,发生还原反应的元素是 。
(3)氧化性:KMnO4_____K2CrO4(填“>”或“<”)。
利用化合价和物质类别推测物质的性质是化学研究的重要手段。
(1)从化合价的角度可以预测物质的性质。
①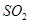 的性质___________(填序号,下同)。
的性质___________(填序号,下同)。
A.只有氧化性 B.只有还原性 C.既有氧化性又有还原性
②将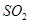 通入酸性
通入酸性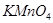 溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是__________
溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是__________
A.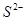 B.
B.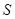 C.
C.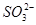 D.
D.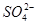
(2)从物质分类的角度可以推测物质的性质。
①已知蛇纹石由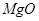 、
、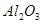 、
、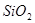 、
、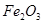 组成。其中
组成。其中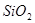 属于_______氧化物,
属于_______氧化物,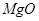 和
和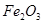 属于_________氧化物(填“酸性”、“碱性”或“两性”)。
属于_________氧化物(填“酸性”、“碱性”或“两性”)。
②现取一份蛇纹石试样进行实验:
I.先将其溶于过量的盐酸中、过滤,滤渣的主要成分是_________。
II.再向滤液中加入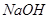 溶液至过量、过滤,滤渣中的主要成分是_________。
溶液至过量、过滤,滤渣中的主要成分是_________。
③若将少量的蛇纹石试样直接溶于过量的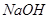 溶液中,所发生的两个反应的化学方程式是_________________________。
溶液中,所发生的两个反应的化学方程式是_________________________。
| |||||
1―5CDBCC 6―10BBABA 11―15CBCDC 16―18ADB
19.(6分)(1)+1(1分) (2)CuI (1分) 0.5(2分)
(3)2、5、2、1(2分)
20.(9分)
|