
题目列表(包括答案和解析)
电化学原理在工业生产中有着重要的作用,请利用所学知识回答有关问题。
(1)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。如图,是电解产生多硫化物的实验装置:
①已知阳极的反应为(x+1)S2-=Sx+S2-+2xe-,则阴极的电极反应式是________________________________________________________________________。
当反应转移x mol电子时,产生的气体体积为____________(标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在氮气气氛下溶解。其原因是(用离子反应方程式表示):___________________________________________________。
(2)MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为______________________。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为_______________________________________________,当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为________,MnO2的理论产量为________g。
(3)用图电解装置可制得具有净水作用的FeO42-。实验过程中,两极均有气体产生,Y极区溶液逐渐生成FeO42-。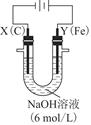
①电解过程中,X极区溶液的pH________(填“增大”“减小”或“不变”)。
②电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=FeO42-+4H2O和________________________________________________________________________,
若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。

(1)[实验一]所用试剂:甲___________、乙___________、丙___________。
丙中现象______________________________________________________________。
实验结论______________________________________________________________。
(2)[实验二]所用试剂:甲___________、乙___________、丙___________。
丙中现象_____________________________________________________________。
实验结论______________________________________________________________。
获取知识和信息是现代人不可缺少的素质,信息产业的飞速发展离不开材料科学的推动。信息产业的核心材料是高纯度的硅,单晶硅可用来制作大规模集成电路、整流器等,硅纯度越高,大规模集成电路的性能就越好。高纯度的单晶硅生产方法有:
方法一:三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
方法二:用金属硅化物(Mg2Si)与盐酸作用制得硅烷,再热分解硅烷可得高纯硅。
根据上述信息回答以下问题:
(1)从方法一生产单晶硅的过程看,由焦炭还原得到的硅为何还要进一步处理?_________________________________________________________。
(2)写出方法二中生产高纯硅的两个化学方程式:
①____________________________________________________________;
②__________________________________________________________。
(3)写出由纯SiHCl3制备高纯硅的化学方程式:____________________________________。
(4)在方法一中,整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是_____________________________________________________。
(5)比较方法一和方法二,分析一下各自的优缺点____________________________________。
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题: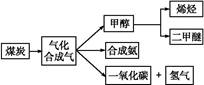
Ⅰ.已知该产业链中某反应的平衡常数表达式为:K=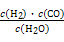 ,写出它所对应反应的化学方程式:
,写出它所对应反应的化学方程式:
。
Ⅱ.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用。工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0 MPa,温度230~280 ℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
ΔH1="-90.7" kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
ΔH2="-23.5" kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
ΔH3="-41.2" kJ·mol-1
(1)写出催化反应室中三个反应的总反应的热化学方程式: 。
(2)在某温度下,2 L密闭容器中发生反应①,起始时CO、H2的物质的量分别为2 mol和6 mol,3 min后达到平衡,测得CO的转化率为60%,则3 min内CO的平均反应速率为 。若同样条件下起始时CO物质的量为4 mol,达到平衡后CH3OH为2.4 mol,则起始时H2为 mol。
(3)下列有关反应③的说法正确的是 。
A.在体积可变的密闭容器中,在反应③达到平衡后,若加压,则平衡不移动、混合气体平均相对分子质量不变、混合气体密度不变
B.若830 ℃时反应③的K=1.0,则在催化反应室中反应③的K>1.0
C.某温度下,若向已达平衡的反应③中加入等物质的量的CO和H2O(g),则平衡右移、平衡常数变大
(4)为了寻找合适的反应温度,研究者进行了一系列实验,每次实验保持原料气组成、压强、反应时间等因素不变,实验结果如图,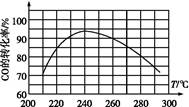
则CO转化率随温度变化的规律是 。
其原因是 。
(1)人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。目前中学课本中的酸碱理论是1889年阿仑尼乌斯(Arrhenius)提出的电离理论。
①1905年富兰克林(FranKlin)深入研究了水和液氨的相似性,把阿仑尼乌斯以水为溶剂的个别现象,推广到任何溶剂,提出了酸碱溶剂理论。溶剂理论认为:凡能电离而产生溶剂正离子的物质为酸,凡能电离而产生溶剂负离子的物质为碱。试写出液氨自身电离的方程式: 。
②1923年丹麦化学家布朗斯特(Bronsted)和英国化学家劳莱(Lowey)提出质子理论。凡是能够释放质子(氢离子)任何含氢原子的分子或离子都是酸;凡是能够与质子(氢离子)结合的分子或离子都是碱。
按质子理论:下列粒子在水溶液既可以看作酸又可看碱的是 。
A、H2O B、NH4+ C、OH- D、HCO3- E、CH3COO- F、Cl-
③1923年路易斯(Lewis)提出广义的酸碱概念。凡是能给出电子对而形成化学键的物质都是碱;凡是能够和电子对结合的物质都是酸。
酸(电子对接受体)+碱(电子对给予体)→反应产物,如:H++OH-→H2O。
试指出下列两个反应中的酸或碱:
(Ⅰ)H3BO3 +H2O ![]() H++B(OH)4-,该反应中的碱是 (填H3BO3或H2O);
H++B(OH)4-,该反应中的碱是 (填H3BO3或H2O);
(Ⅱ)NaH+H2O ==NaOH+H2↑,该反应中的酸是 (填NaH 或H2O)。
(2)已知A元素原子的K、L层电子数之和比M、L层电子数之和多一个电子;B元素原子核外电子占有9个轨道,且有1个未成对电子;C元素原子核外3p亚层中3个轨道还需5个电子才能达到全充满。D元素只有两个电子层,且最高化合价与最低化合价的代数和为零;E原子半径最小;F元素最外层电子排布为nSnnPn+1。按要求填写
① B的电子排布式是: ,A、B两元素形成的化合物的晶体类型是 。
②D元素单质的晶体类型是 ,C单质的制备方法是: 。
③E和F形成的化合物空间构型为 ,该物质比D与E形成的化合物更容易液化的原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com