
题目列表(包括答案和解析)
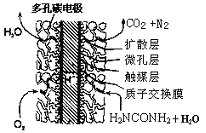
合成氨然后再生产尿素是最重要的化工生产。
I.在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:
3H2(g) + N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
|
|
甲 |
乙 |
丙 |
|
反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
2 mol NH3 |
|
达到平衡的时间/min |
|
5 |
8 |
|
平衡时N2的浓度/mol·L-1 |
c1 |
1.5 |
|
|
NH3的体积分数 |
ω1 |
|
ω3 |
|
混合气体密度/g·L-1 |
ρ1 |
ρ2 |
|
(1)容器乙中反应从开始到达平衡的反应速率为v(H2)=___________。
(2)在该温度下甲容器中反应的平衡常数K= (用含c1的代数式表示)。
(3)分析上表数据,下列关系正确的是________(填序号):
a.2c1 > 1.5 b.2ρ1 = ρ2 c.ω3 = ω1
II.工业上用氨气合成尿素(H2NCONH2)的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)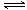 H2NCOONH4 (l) (氨基甲酸铵)
△H1
H2NCOONH4 (l) (氨基甲酸铵)
△H1
第二步:H2NCOONH4(l)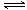 H2O(l)+H2NCONH2(l)
△H2
H2O(l)+H2NCONH2(l)
△H2
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如左下图I所示:
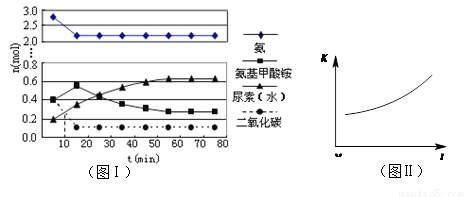
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②第二步反应的平衡常数K随温度T的变化如右上图II所示,则△H2 0;③若第一步反应升温时氨气浓度增大,请在图II中画出第一步反应K1随温度T变化曲线,并作出必要的标注。
(5)氨和尿素溶液都可以吸收硝工业尾气中的NO、NO2,将其转化为N2。
①尿素与NO、NO2三者等物质的量反应为:CO(NH2)2+NO+NO2 =CO2+2N2+2H2O
该反应中的氧化剂为 (写化学式)。
②已知:N2(g)+O2(g)= 2NO(g) △H =a kJ·mol-1
N2(g)+3H2(g)= 2NH3(g) △H2=bkJ· kJ·mol-1
2H2(g)+O2(g)= 2H2O(g) △H = c kJ·mol-1
则4NH3(g) +4NO(g) +O2(g)= 4N2(g)+6H2O(g) △H= 。
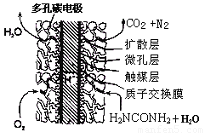
③尿素燃料电池结构如下图所示。其工作时负极电极反应式可表示为 。
合成氨然后再生产尿素是最重要的化工生产。
I.在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:
3H2(g) + N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
| 甲 | 乙 | 丙 | ||
| 反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 | ||
| 达到平衡的时间/min | | 5 | 8 | ||
| 平衡时N2的浓度/mol·L-1 | c1 | 1.5 | | ||
| NH3的体积分数 | ω1 | | ω3 | ||
| 混合气体密度/g·L-1 | ρ1 | ρ2 | |
 H2NCOONH4 (l) (氨基甲酸铵) △H1
H2NCOONH4 (l) (氨基甲酸铵) △H1 H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2 
 CO2(g) +H2(g) △H=-42KJ/mol
CO2(g) +H2(g) △H=-42KJ/mol 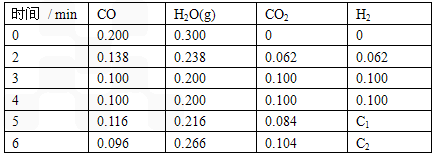
| 1.容器 | 2.甲 | 3.乙 | 4.丙 |
| 5.反应物投入量 | 6.1molCO、2molH2 | 7.l molCH3OH | 8.2molCO、4molH2 |
| 9.CH30H昀浓度(mol/L) | 10.cl | 11.c2 | 12.c3 |
| 13.反应的能量变化 | 14.放出Q1kJ | 15.吸收Q2kJ | 16.放出Q3kJ |
| 17.平衡常数 | 18.Kl | 19.K2 | 20.K3 |
| 21.反应物转化率 | 22.al | 23.a2 | 24.a3 |
(21分)(1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/LH2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃ (t2>t1),混合后溶液的比热容为c = 4.18J/(g·℃),溶液的密度都近似为1g/mL,中和热△H=__________(填表达式,不用化简);若将H2SO4溶液换成相同物质的量浓度的CH3COOH溶液,测得的△H______填(“偏大”、“偏小”或“相同”);若将稀硫酸换成浓硫酸来做该实验,测得的△H_______(填“偏大”、“偏小”或“相同”)。
(2)某高能化学物质N2H2内,氮元素的杂化类型为____,电子式为____,一个分子中有σ键 个 ,π 键 个。
(3).在密闭容器中进行可逆反应: CO(g)+NO2(g)CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
①增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
②容器体积不变:若通人CO2气体,平衡 移动,反应混合物的颜色 。若通人N2气体,平衡 移动,反应混合物的颜色 。③加入催化剂,平衡 移动。
(4)下表是几种常用燃料(1 mol)完全燃烧时放出的热量:
| 物质 | 炭粉(C) | 一氧化碳(CO) | 氢气(H2) | 甲烷(CH4) | 乙醇(C2H5OH) |
| 状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
| 热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1 367 |
①从热量角度分析,目前最适合家庭使用的优质气体燃料是________。
②写出管道煤气中的一氧化碳燃烧热的热化学方程式_______________________
③充分燃烧1mol表中各种燃料,排放出二氧化碳的量最多的是________。
④矿物燃料储量有限,而且在燃烧过程中会产生污染。根据能源多样化的发展战略,我国开发利用的绿色能源有________等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com