
题目列表(包括答案和解析)
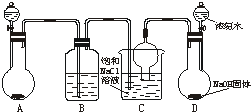 侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为:
侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为:侯德榜是我国著名的工业化学家,又是一个伟大的爱国者,他所发明的制碱法为中国化学工业乃至世界化学工业作出了重要的贡献,被誉为“侯氏制碱法”。请你回答以下问题:
(1)“侯氏制碱法”中的“碱”其实不是烧碱,请实际情况出向它的溶液中滴加少量稀盐酸的离子方程式____________________________________。
(2)某同学为了验证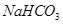 和
和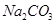 的稳定性,设计了如图甲的实验装置(铁架台、夹持仪器、加热装置等已省略),你认为在X中应放的物质_____________________(填化学式)。
的稳定性,设计了如图甲的实验装置(铁架台、夹持仪器、加热装置等已省略),你认为在X中应放的物质_____________________(填化学式)。
(3)某化学研究性学习小组在老师的指导下,模拟侯德榜先生的制碱原理设计了如图乙的实验装置。
A.实验的操作步骤中,你认为打开旋塞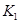 、
、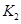 的合理顺序应为:先打开______,后打开________(填字母代号)。 简述理由____________________________。
的合理顺序应为:先打开______,后打开________(填字母代号)。 简述理由____________________________。
B.在盛饱和食盐水的装置中发生反应的离子方程式为________________________;能析出碳酸氢钠晶体的原因是_________(填序号)。
a. 碳酸氢钠难溶于水 b. 碳酸氢钠受热易分解
c. 碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
装置中气胆的作用是___________________________________________________。
C.工业上若需制备纯碱,则上述原料中除了饱和食盐水外,其他原料用工业常用方法制取,写出工业制备两种原料气的主要化学反应方程式__________________。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法:___________________________。
(5)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:原子利用率(%)=_______________。
侯德榜是我国著名的工业化学家,又是一个伟大的爱国者,他所发明的制碱法为中国化学工业乃至世界化学工业作出了重要的贡献,被誉为“侯氏制碱法”。请你回答以下问题:
(1)“侯氏制碱法”中的“碱”其实不是烧碱,请实际情况出向它的溶液中滴加少量稀盐酸的离子方程式____________________________________。
(2)某同学为了验证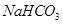 和
和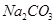 的稳定性,设计了如图甲的实验装置(铁架台、夹持仪器、加热装置等已省略),你认为在X中应放的物质_____________________(填化学式)。
的稳定性,设计了如图甲的实验装置(铁架台、夹持仪器、加热装置等已省略),你认为在X中应放的物质_____________________(填化学式)。
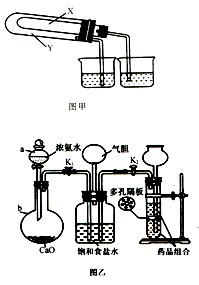
(3)某化学研究性学习小组在老师的指导下,模拟侯德榜先生的制碱原理设计了如图乙的实验装置。
A.实验的操作步骤中,你认为打开旋塞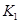 、
、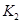 的合理顺序应为:先打开______,后打开________(填字母代号)。 简述理由____________________________。
的合理顺序应为:先打开______,后打开________(填字母代号)。 简述理由____________________________。
B.在盛饱和食盐水的装置中发生反应的离子方程式为________________________;能析出碳酸氢钠晶体的原因是_________(填序号)。
a. 碳酸氢钠难溶于水 b. 碳酸氢钠受热易分解
c. 碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
装置中气胆的作用是___________________________________________________。
C.工业上若需制备纯碱,则上述原料中除了饱和食盐水外,其他原料用工业常用方法制取,写出工业制备两种原料气的主要化学反应方程式__________________。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法:___________________________。
(5)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:原子利用率(%)=_______________。
侯德榜是我国著名的工业化学家,又是一个伟大的爱国者,他所发明的制碱法为中国化学工业乃至世界化学工业作出了重要的贡献,被誉为“侯氏制碱法”。请你回答以下问题:
(1)“侯氏制碱法”中的“碱”其实不是烧碱,请实际情况出向它的溶液中滴加少量稀盐酸的离子方程式____________________________________。
(2)某同学为了验证![]() 和
和![]() 的稳定性,设计了如图甲的实验装置(铁架台、夹持仪器、加热装置等已省略),你认为在X中应放的物质_____________________(填化学式)。
的稳定性,设计了如图甲的实验装置(铁架台、夹持仪器、加热装置等已省略),你认为在X中应放的物质_____________________(填化学式)。
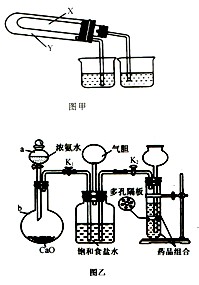
(3)某化学研究性学习小组在老师的指导下,模拟侯德榜先生的制碱原理设计了如图乙的实验装置。
A.实验的操作步骤中,你认为打开旋塞![]() 、
、![]() 的合理顺序应为:先打开______,后打开________(填字母代号)。 简述理由____________________________。
的合理顺序应为:先打开______,后打开________(填字母代号)。 简述理由____________________________。
B.在盛饱和食盐水的装置中发生反应的离子方程式为________________________;能析出碳酸氢钠晶体的原因是_________(填序号)。
a. 碳酸氢钠难溶于水 b. 碳酸氢钠受热易分解
c. 碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
装置中气胆的作用是___________________________________________________。
C.工业上若需制备纯碱,则上述原料中除了饱和食盐水外,其他原料用工业常用方法制取,写出工业制备两种原料气的主要化学反应方程式__________________。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法:___________________________。
(5)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:原子利用率(%)=_______________。
侯德榜是我国著名的工业化学家,又是一个伟大的爱国者,他所发明的制碱法为中国化学工业乃至世界化学工业作出了重要的贡献,被誉为“侯氏制碱法”。请你回答以下问题:
(1)“侯氏制碱法”中的“碱”其实不是烧碱,请实际情况出向它的溶液中滴加少量稀盐酸的离子方程式____________________________________。
(2)某同学为了验证![]() 和
和![]() 的稳定性,设计了如图甲的实验装置(铁架台、夹持仪器、加热装置等已省略),你认为在X中应放的物质_____________________(填化学式)。
的稳定性,设计了如图甲的实验装置(铁架台、夹持仪器、加热装置等已省略),你认为在X中应放的物质_____________________(填化学式)。
(3)某化学研究性学习小组在老师的指导下,模拟侯德榜先生的制碱原理设计了如图乙的实验装置。
A.实验的操作步骤中,你认为打开旋塞![]() 、
、![]() 的合理顺序应为:先打开______,后打开________(填字母代号)。 简述理由____________________________。
的合理顺序应为:先打开______,后打开________(填字母代号)。 简述理由____________________________。
B.在盛饱和食盐水的装置中发生反应的离子方程式为________________________;能析出碳酸氢钠晶体的原因是_________(填序号)。
a. 碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c. 碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
装置中气胆的作用是___________________________________________________。
C.工业上若需制备纯碱,则上述原料中除了饱和食盐水外,其他原料用工业常用方法制取,写出工业制备两种原料气的主要化学反应方程式__________________。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法:___________________________。
(5)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:原子利用率(%)=_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com