
题目列表(包括答案和解析)
氯碱工业中,通过电解饱和食盐水获得重要的化工原料:氯气、氢气和氢氧化钠。其中氯气用途十分广泛,除用于净水、环境消毒外,还用于生产盐酸、硅、聚氯乙烯、氯苯等。
(1)写出工业上制取盐酸的化学反应方程式:
(2)工业上可用氯气和石灰乳为原料制造漂白粉,写出漂白粉在空气中的漂白原理(用化学方程式表示) 。
(3)工业上生产半导体材料硅的流程如下: 
①写出在制备粗硅时反应的化学方程式_____________________________,此反应中焦炭的作用是____________(填“氧化剂”或“还原剂”),若有 0.6mol硅生成,反应中转移电子的物质的量是 mol。
②粗硅与氯气反应后得到沸点较低的液态四氯化硅中常混有一些高沸点,难挥发性杂质,必须进行分离提纯。其提纯方法为____________。(填序号)
| A.蒸馏 | B.过滤 | C.萃取 | D.结晶 |
氯碱工业中,通过电解饱和食盐水获得重要的化工原料:氯气、氢气和氢氧化钠。其中氯气用途十分广泛,除用于净水、环境消毒外,还用于生产盐酸、硅、聚氯乙烯、氯苯等。
(1)写出工业上制取盐酸的化学反应方程式:
(2)工业上可用氯气和石灰乳为原料制造漂白粉,写出漂白粉在空气中的漂白原理(用化学方程式表示) 。
(3)工业上生产半导体材料硅的流程如下:

①写出在制备粗硅时反应的化学方程式_____________________________,此反应中焦炭的作用是____________(填“氧化剂”或“还原剂”),若有 0.6mol硅生成,反应中转移电子的物质的量是 mol。
②粗硅与氯气反应后得到沸点较低的液态四氯化硅中常混有一些高沸点,难挥发性杂质,必须进行分离提纯。其提纯方法为____________。(填序号)
A.蒸馏 B.过滤 C.萃取 D.结晶
③由四氯化硅通入氢气得到高纯硅和氯化氢气体,写出该反应的化学方程式:
________________________________________________________________________。
某研究小组以苯甲醛为原料,制备苯甲酸和苯甲醇.反应原理如下:

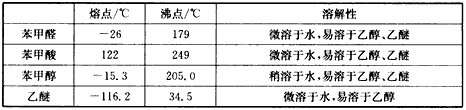
有关物质的部分物理性质如下:

实验步骤:
(1)在250 mL锥形瓶中,放入9 g KOH和9 mL水,配成溶液,冷却至室温.加入10.5 g新蒸馏的苯甲醛,塞紧瓶塞,用力振荡,使之变成糊状物,放置24 h.
①苯甲醛要求新蒸馏的,否则会使________(填物质名称)的产量相对减少.
②用力振荡的目的是________.
(2)分离苯甲醇
①向锥形瓶中加入30 mL水,搅拌,使之完全溶解.冷却后倒入分液漏斗中,用30 mL乙醚萃取苯甲醇(注意留好水层).30 mL 乙醚分三次萃取的效果比一次萃取的效果________(填“好”或“差”).
②将醚层依次用饱和亚硫酸氢钠溶液、饱和碳酸钠溶液和水各5 mL洗涤,再用无水硫酸镁干燥.将干燥后的乙醚溶液转移到100 mL蒸馏烧瓶中,投入沸石,连接好普通蒸馏装置,加热蒸馏并回收乙醚,应选择的加热方法是________(填字母代号).
A.水浴加热
B.油浴加热
C.沙浴加热
D.用酒精灯直接加热
③改用空气冷凝管蒸馏,收集________℃的馏分.
(3)制备苯甲酸
在乙醚萃取过的水溶液中,边搅拌边加入浓盐酸酸化至pH=3.5左右.冷却使结晶完全,抽滤,洗涤、干燥.抽滤完毕或中途停止抽滤时,应先________.

| 熔点/℃ | 沸点/℃ | 溶解性 | |
| 苯甲醛 | -26 | 179 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲酸 | 122 | 249 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲醇 | -15.3 | 205.0 | 稍溶于水,易溶于乙醇、乙醚 |
| 乙醚 | -116.2 | 34.5 | 微溶于水,易溶于乙醇 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com