
题目列表(包括答案和解析)
 (1)阅读、分析下列两个材料:材料一:
(1)阅读、分析下列两个材料:材料一:| 物质 | 熔点/℃ | 沸点/℃ | 密度/g?cm3 | 溶解性 |
| 乙二醇(C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意以互溶 |
2,3-二氧呋喃是抗肿瘤药物的中间体,四氢呋喃是常用溶剂,它们可以通过下列反应流程来合成:

已知:
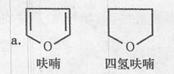
b.在碱存在的条件下,卤代烃可与酵发生如下反应:
R—X+R′—OH→R—O—R′+HX
请填写下列空白:
(1)化合物B的名称为 ;反应①的反应类型是 ;反应②的反应条件是 。
(2)写出结构简式:A为 ;C为 ;A与乙酸反应生成的酯为 。
(3)工业上可由二元醇D( C4H10O2)在一定条件下脱水制得四氢呋喃,该反应的化学方程式为 。
(4)写出满足下列条件的呋喃的一种同分异构体的结构简式 。
I.没有支链,且一元取代产物只有两种。
Ⅱ.不能与银氨溶液发生银镜反应。
Ⅲ.核磁共振氢谱图有2个峰,其面积之比为1:3。
(5)2,3—二氢呋喃在一定的条件下可以转变成四氢呋喃,如何用简单的化学方法检验2,3-二氢呋喃是否完全转化? 。
高锰酸钾和二氧化锰是中学化学常用的化学试剂。根据下面相关的信息回答下列问题:
(1)已知:
②
锰有多种化合价,如+7、十6、+4、+2价等,在中性溶液里高锰酸钾的还原产物为 (填化学式)。
(2)查阅相关资料:发生如下反应(反应未配平):

已知在高锰酸钾固体表面滴加浓盐酸,发生的半反应为
如果在盛有氯化锰溶液的试管中加入适量XeO3,振荡试管,可能观察到的现象是 。
(3)已知草酸(H2C2O4)为二元弱酸,取少量草酸晶体溶于酸性高锰酸钾溶液,溶液的紫色褪去。
写出该反应的离子方程式 。
(4)MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为 ,当蓄电池中有4mol H+被消耗时,则电路中通过的电子的物质的量为 ,MnO2的理论产量为 g。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com