
题目列表(包括答案和解析)
在提纯某含有氯化钙的食盐并测定其质量分数的实验中,回答下列有关问题:
(1)准确称取10g样品,溶于适量蒸馏水中,再加入5.5g 20%的X溶液(稍过量).反应后过滤,得沉淀物1g.加入的X是________.
A.Na2CO3 B.K2CO3 C.NaOH D.AgNO3
(2)往滤液中加入2g 5%的稀盐酸(过量),加入过量稀盐酸的理由是________,反应的化学方程式为________.
(3)将加入稀盐酸后的滤液放在蒸发皿里加热蒸发,加热过程中,要用玻璃棒不断搅拌,其作用是________.蒸发后得到固体氯化钠10.1g.
(4)计算样品中氯化钠的质量分数时,在①10g样品,②5.5g 20%的X溶液,③1g沉淀物,④2g 5%的稀盐酸,⑤10.1g固体氯化钠五个数据中,无须用到的是________.(填序号)
| 物质 | M | N | P | Q |
| 反应前质量(g) | 18 | 1 | 32 | 2 |
| 反应后质量(g) | X(未知) | 26 | 12 | 2 |
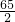 =
=
(08四川攀枝花)一个密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得数据见下表。下列说法中正确的是( )
A.X=7g B.在该反应中,丙物质一定做催化剂
C.该反应是分解反应 D.在该反应的化学方程式中,丙、丁的化学计量数之比为1∶l
|
物质 |
甲 |
乙 |
丙 |
丁 |
|
反应前质量 |
8g |
35g |
5g |
8g |
|
反应后质量 |
2g |
X |
5g |
42g |
25℃时,有x、y、z三种物质的饱和溶液:①x饱和溶液的溶质的质量分数为15%;②100g 10%的y溶液中加入5g y固体,恰好配成饱和溶液;③一定量z溶液蒸发掉10g 水再恢复到25℃,或向其中加入2g z固体都恰好形成饱和溶液.则x、y、z三种物质在25℃时的溶解度大小排列顺序正确的是
[ ]
A.x>y>z B.y>z>x
C.z>x>y D.z>y>x
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com