A、B、C、D、E为短周期元素,其原子序数依次增大.其中,A元素原子半径最小;B元素原子的电子总数与最外层电子数之比为3:2;C元素最高价氧化物对应水化物与其氢化物反应生成一种盐甲.A、E同主族,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.请回答:
(1)写出B元素在周期表中的位置
第二周期、第ⅣA族
第二周期、第ⅣA族
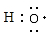
,C单质的电子式是
.
(2)常温下,甲的水溶液pH
<
<
7(填“>、<或=”),其原因是(用离子方程式表示)
NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
.
(3)B、D、E组成的化合物丙,其水溶液pH大于7.则丙的组成可能是
Na2CO3
Na2CO3
(填化学式).

(4)A和B组成化合物丁,其相对分子质量为16.将如图装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状液滴生成等现象.油状液滴的成分是
CH2Cl2、CHCl3、CCl4
CH2Cl2、CHCl3、CCl4
(填化学式).
(5)A、D、E组成的化合物乙与氯化亚铁溶液反应可用于制备Fe3O4.制备流程如下:

①写出步骤(Ⅰ)反应的离子方程式
Fe2++2OH-═Fe(OH)2↓
Fe2++2OH-═Fe(OH)2↓
.
②步骤(Ⅱ)的反应方程式是4Fe(OH)
2+2H
2O+O
2═4Fe(OH)
3,制备时应控制“一定量空气”的目的是
控制O2的量,防止Fe(OH)2全部转化为Fe(OH)3
控制O2的量,防止Fe(OH)2全部转化为Fe(OH)3
.
③由沉淀M获得Fe
3O
4的过程中发生的反应为
Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O
Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O
.


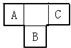 A、B、C、D、E为短周期元素,A、B、C在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.D与A同周期,其最高正价与最低负价代数和为零.A、E可形成AE3型分子,分子中只存在极性键.
A、B、C、D、E为短周期元素,A、B、C在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.D与A同周期,其最高正价与最低负价代数和为零.A、E可形成AE3型分子,分子中只存在极性键. 







 A、B、C、D、E为短周期元素组成的中学常见物质,它们转化关系如图所示(部分产物、条件略去).下列说法正确的是( )
A、B、C、D、E为短周期元素组成的中学常见物质,它们转化关系如图所示(部分产物、条件略去).下列说法正确的是( )