
题目列表(包括答案和解析)
下表列出了几种物质的物理性质数据,请参考相关物质的数据合成1-溴丁烷。实验室制备1—溴丁烷的反应如下:①NaBr + H2SO4 ?= HBr + NaHSO4 ;②R—OH + HBr ![]() R—Br +H2O可能存在的副反应有:加热过程中反应混合物会呈现黄色或红棕色;醇在浓硫酸存在下脱水生成烯和醚等。请回答下列问题:
R—Br +H2O可能存在的副反应有:加热过程中反应混合物会呈现黄色或红棕色;醇在浓硫酸存在下脱水生成烯和醚等。请回答下列问题:
正丁醇 | 1-溴丁烷 | 正丁醚 | |
熔点/℃ | -89.53 | -112.4 | -98 |
沸点/℃ | 117.7 | 101.6 | 142 |
密度/g.cm-3 | 0.8098 | 1.2758 | 0.769 |
水溶性 | 微溶 | 不溶 | 不溶 |
实验一:实验室制取少量1-溴丁烷的装置如图所示。在a中,加入7.0ml正丁醇、足量的溴化钠和1:1的硫酸。
(1)写出装置图中玻璃仪器的名称:a ▲ ,b ▲ 。
(2)配制体积比1:1的硫酸所用的定量仪器为 ▲ (填字母)。
A.天平 B.量筒 C.容量瓶
(3)制备操作中,加入的浓硫酸必须进行适当的稀释,其目的是 ▲ (填字母)。
A.减少副产物烯和醚的生成 B.减少Br2的生成
C.减少HBr的挥发 D.水是反应的催化剂

实验二:先利用图甲装置把制备得到的粗产品水洗,水洗时需加入碳酸钠固体加以提纯;再利用图乙装置进行蒸馏提纯。
|
|

(4)用图甲装置进行水洗提纯时,往往要加入Na2CO3固体,其作用主要是除去 ▲ 。在图乙装置中加入适当的干燥剂,并将洗涤后的粗产品通过分液漏斗转移到图乙装置中进行蒸馏。下列可做为粗产品蒸馏提纯时的干燥剂的是 ▲ 。(填字母)
A.NaOH固体 B.碱石灰 C.无水硫酸钠 D.无水氯化钙
(5)用图乙装置进行蒸馏提纯时,当温度计显示 ▲ 时,收集1-溴丁烷。
(6)若获得了1-溴丁烷为7.0克,试计算其产率 ▲ 。
利用化石燃料开采、加工过程产生的H2S废气制取氢气,既廉价又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为_________
②常温下,不能与M单质发生反应的是_________(填序号)
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH e.Na2CO3固体
(2)利用H2S废气制取氢气来的方法有多种
①高温热分解法
已知:H2S(g)=H2+ S2(g)
S2(g)
在恒温密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见右图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算985℃时H2S按上述反应分解的平衡常数K=________;说明温度的升高,曲线b向曲线a逼近的原因:___________

②电化学法
该法制氢过程的示意图如右。反应池中反应物的流向采用气、液逆流方式,其目的是___________;反应池中发生反应的化学方程式为_____________________。反应后的溶液进入电解池,电解总反应的离子方程式为_______________________。
利用化石燃料开采、加工过程产生的H2S废气制取氢气,既廉价又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为_________
②常温下,不能与M单质发生反应的是_________(填序号)
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH e.Na2CO3固体
(2)利用H2S废气制取氢气来的方法有多种
①高温热分解法
已知:H2S(g)=H2+ S2(g)
S2(g)
在恒温密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见右图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算985℃时H2S按上述反应分解的平衡常数K=________;说明温度的升高,曲线b向曲线a逼近的原因:___________


②电化学法
该法制氢过程的示意图如右。反应池中反应物的流向采用气、液逆流方式,其目的是___________;反应池中发生反应的化学方程式为_____________________。反应后的溶液进入电解池,电解总反应的离子方程式为_______________________。
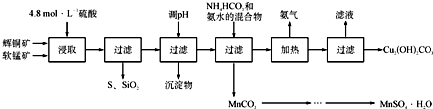
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe 3+ | 1.1 | 3.2 |
| Mn 2+ | 8.3 | 9.8 |
| Cu 2+ | 4.4 | 6.4 |
黄铁矿(主要成分为FeS2)是生产硫酸的主要原料.高温时,黄铁矿在空气中煅烧[设空气中V(N2)∶V(O2)=4∶1且不含其他气体],可发生下列反应:
4FeS2+11O2根据题意完成下列计算:
1.若把2.00 g某黄铁矿试样在足量空气中充分灼烧后(杂质不反应、不挥发),得到1.56 g残渣,则该黄铁矿的纯度为________.
2.煅烧70t黄铁矿(含硫35%,杂质不含硫且不反应)生产出72.8t硫酸铵.若黄铁矿制取硫酸时的利用率为80%,则在制取硫酸铵时硫酸的利用率为________(答案保留两位小数).
3.为使FeS2煅烧完全生成Fe2O3,工业上使用过量空气,当空气过量20%时,煅烧后的混合气体平均相对分子质量为________(答案保留两位小数).
4.硫酸工业的尾气可以使用氨水进行吸收,既防止了有害物质的排放,也同时生产副产品氮肥.已知吸收尾气后的氨水全部转化为铵盐.取两份相同体积的铵盐溶液,一份中加入足量硫酸,产生0.09 mol SO2(假设气体已全部逸出,下同);另一份中加入足量Ba(OH)2,产生0.16 mol NH3,同时得到21.86 g沉淀.通过计算,求铵盐溶液中各溶质成分与物质的量浓度之比.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com