
题目列表(包括答案和解析)
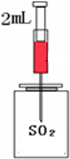
氧化锑是一种新型的阻燃材料,运用于纺织、塑料工业.其中锑元素与氮元素同族.
(1)锑在元素周期表中的位置是第________周期第________族.
(2)锑的最高价氧化物的化学式是________,若该化合物中锑的质量分数为75.30%,则锑的相对原子量是________(保留4位有效数字).
(3)锑跟同周期的锡和碲相比较,元素的非金属性按照由强到弱的顺序排列是(用元素符号填空):________>________>________.
(4)硫化锑分散在水中可形成橙黄色的胶体,当用一束光线平射它时,发现有一条光亮的“通路”,这个现象叫做________现象.
(5)如在硫化锑胶体里插入两根石墨电极,通直流电后,在阳极附近颜色逐渐变深,这种现象叫做________,硫化锑胶体微粒带________电荷.
(12分)【化学——物质结构与性质】
氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是 。
| A.N2可用于填充霓虹灯。其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量 |
| B.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na |
| C.基态As原子中,电子占据的最高能级为4d |
| D.Bi原子中最外层有5个能量相同的电子 |
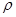 g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。
g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。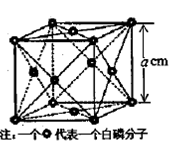
Ⅰ右图中A、B、C、D四条曲线是表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点变化曲线,其中A、D分别表示________、________族元素气态氢

化物的沸点变化;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是________;
图中第2周期有三种元素的气态氢化物沸点显著高于相应的同族第3周期元素气态氢化物的沸点,其原因是________
Ⅱ.已知氨分子内键与键的夹角约为107o18’.从反应NH3+H+→NH4+可知:NH4+中有一根键比较特殊,其结构可表示为A式.但是,虽然有一根键形成过程与众不同,而其结果是完全相同的,都是N、H原子间共用一对电子,键与键的夹角均为109o28’.故NH4+的结构也可表示为B式.

(1)还有一些你熟悉的分子或离子中,也存在上述特殊共价键,如:________等.
(在下列微粒中选择填空:[Ag(NH3)2]+,PCl5,Fe(SCN)3,NH3·H2O,H3O+)
(2)写出H3O+的电子式________;你认为H3O+中键与键的夹角与下列哪个角度最接近?________
A、120o
B、109o28'
C、107o18'
D、60o
(3)氮化硼(BN)是一种新型无机非金属材料,它有两种晶型:金刚石晶型和石墨晶型.其中,金刚石晶型的氮化硼材料具有硬度大、熔点高等特性,它的结构中也含有上述特殊共价键.则:在金刚石晶型的氮化硼中,每个硼原子与________个氮原子以B─N键连接,原子间相互连接的最小的环上有________个氮原子和________个硼原子.
β型硼氮化合物-(BN)n是一种无机合成材料[最简式为
(BN)],具有高硬度、耐高温的特点,是做超高温耐热陶瓷材料、磨料、精磨刃具的好材料.用硼砂(Na2B4O7)与尿素在高温高压下反应可以获得.例如:Na2B4O7+2CO(NH2)2→4(BN)+Na2O+2CO21.请用氧化物的形式表示硼砂的化学式________.β型(BN)n比晶体硅具有更高硬度和耐热性的原因是:________.
2.(1)上述反应式中具有4种不同能量电子的原子,它代表的元素在周期表中处于________周期,第________族.
(2)能用于比较N与O非金属性相对强弱的事实是________.
A.最高价氧化物对应水化物的酸性
B.H2O(g)比NH3(g)稳定
C.单质与H2反应的难易程度
D.NO中氮元素显正价,氧元素显负价
3.写出指定分子的电子式:生成物中含极性键的非极性分子________.
4.与硼同主族且相邻周期的元素,其单质与NaOH(aq)反应的离子方程式为:________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com