
题目列表(包括答案和解析)
将100g浓度为18.4 mol?L-1、密度为ρ的浓硫酸稀释成9.2 mol?L-1的硫酸,所加水的体积
A.100mL B.小于100mL C.大于100mL D.等于100g/ρ
 (2012?南京二模)碘酸钙[Ca(IO3)2]是目前广泛使用的既能补碘又能补钙的新型食品和饲料添加剂.
(2012?南京二模)碘酸钙[Ca(IO3)2]是目前广泛使用的既能补碘又能补钙的新型食品和饲料添加剂.| 温 度/℃ 物质 |
0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
| KCl | 28.1 | 31.2 | 34.2 | 40.1 | 45.8 | 51.3 |
| CaCl2 | 59.5 | 64.7 | 74.5 | 128 | 137 | 147 |
| Ca(IO3)2 | 0.119(5℃) | 0.195(15℃) | 0.307(25℃) | 0.520 | 0.621 | 0.669 |
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2Fe(SO4)2?6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
| 1 |
| V |
| 1 |
| V |
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2Fe(SO4)2?6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度/g/100g水 | 18.5 | 20.8 | 26.3 | 32.8 | 40.1 | 48.4 | 52.4 | 50.9 | 43.7 |
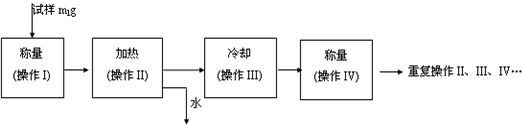
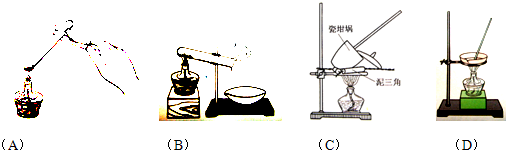
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com