
题目列表(包括答案和解析)
(10分)、有机物A由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
|
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)有机物A的相对分子质量为: 。 |
|
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2g,硫酸铜粉末没有变蓝,石灰水中有10.0g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48L无色无味气体(标准状况)。 |
(2)9.0g有机物A完全燃烧时,经计算:生成CO2共为 mol, 生成的H2O g。 有机物A的分子式 。 |
|
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(4)A的结构简式 。
|
|
(4)有机物A可跟乙酸发生酯化反应,其质量比为3:2;有机物A也可跟乙醇发生酯化反应,其物质的量比为1:1;且酯化反应分别发生在链中和链端。 |
|
|
(5)有机物A可否发生缩聚反应?若能,请直接写出反应的化学方程式;若不能,请指出原因 |
(10分)已知A为常见的金属单质,根据下图所示的关系: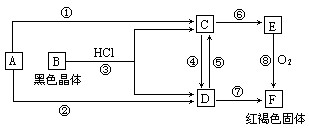
(1)确定A、B的化学式,A为 __________,B为 ___________。
(2)C和D可相互转化,描述C→D溶液的颜色变化:____________________。
④的离子方程式:_____________________________________________________。
⑤的离子方程式:_____________________________________________________。
(3)由E→F的实验现象为:___________________________________。
(10分)已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系。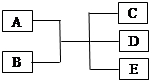
(1)若A是一种黑色单质,B是一种常见的难挥发性酸,C、D都是气体,试写出此反应的化学方程式 。
(2)若A是一种紫红色单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式是 ,B在反应中表现出的性质是 、 。
(3)若实验室中利用A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小的气体,试写出此反应的化学方程式 ;实验室检验C的方法 。
(10分) (1)将一小块金属钠投入水中,发生反应的化学方程式为 ,请回答:可观察到的实验现象是_____________(填字母)。
a.钠沉到水底
b.钠熔成小球
c.小球四处游动
d.向反应后的溶液中滴加酚酞试剂,溶液变为红色
(2)在实验室中,通常将金属钠保存在 (填字母)。
a.水中 b.煤油中 c.四氯化碳中
(3)过氧化钠与水反应,化学方程式: 。
(4)过氧化钠与二氧化碳反应,化学方程式: 。
(10分)已知A是治疗胃酸过多症的一种药剂,B是一种淡黄色固体,A、B以物质的量之比1∶1混合加热生成C、D、E三种物质,E、F、J是常见的气体单质,有如下转化关系: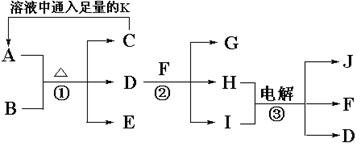
(1)写出A与D反应的离子方程式_________________________________________;
(2)写出反应②的化学方程式 __________________________________________。
(3)电解③时阳极产生气体168mL(标准状况),电解后溶液的体积为150mL,此时溶液的pH为________________。
(4)将等物质的量的A和C溶于100mL水中,下列溶液说法不正确的是_________。
A.2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3)
B.c(Na+)+ c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
C.c(CO32-)+2c(OH-)= 3c(H2CO3) + c(HCO3-) + 2c(H+)
D.c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+)
(5)若A、B混合后加热得到纯净物,反应的方程式为_________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com