
题目列表(包括答案和解析)


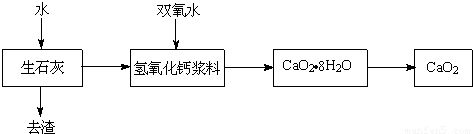
过氧化钙(CaO2)具有较强的漂白、杀菌消毒作用,对环境无危害,是一种很有应用价值和发展前途的化工产品.工业上利用双氧水和氢氧化钙制备CaO2,已知:双氧水高温下不稳定、会分解.下图是简化后的工艺流程,请回答下列问题.

(1)生石灰中加水发生的化学反应方程式是________,该反应是________反应(填“放热”或“吸热”).在加入双氧水前,氢氧化钙浆料需经过________处理(填“保温”、“升温”、“降温”)处理.
(2)氢氧化钙浆料中加入双氧水的反应属于化合反应,则反应方程式为________,获得的产品CaO2·8H2O的相对分子质量为________,其中Ca、O、H的元素质量比为________.
(3)CaO2常用于鱼虾运输过程中的供氧剂,其反应原理是:2CaO2+2________=2Ca(OH)2+O2↑,若需要提供12.8 g氧气,则需要CaO2________g.Na2O2也能与水反应原理与CaO2相同,但却不能作为鱼虾运输的供氧剂,请分析其原因________.
| 实验操作 | 实验现象 | 实验结论 |
| 把少量漂白粉样品加入水中,通入足量的CO2气体,________. | ________. | 漂白粉的漂白作用已失效. |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com