
题目列表(包括答案和解析)
甲同学在用双氧水制取氧气时,误把Fe2O3粉末当成MnO2放入双氧水中,发现也有大量气泡产生。他意识到这个错误后,联想到MnO2可作为H2O2分解的催化剂,那么Fe2O3能否作为H2O2分解的催化剂呢?请你一起参与探究,并填写下列空白。
【猜想】Fe2O3能作为H2O2分解的催化剂。
【实验验证】甲同学依次设计了三个实验:
实验一:取一定量的H2O2溶液于试管中,观察到有极少量气泡产生,伸入带火星的木条,没有复燃。说明H2O2溶液常温下缓慢分解。
实验二:在实验一的试管中加入W g Fe2O3粉末,有大量气泡产生,然后伸入带火星的木条,木条复燃。说明_____________________________________。
实验三:待反应结束后,将试管里的不溶物滤出,并洗涤、干燥、称量,固体质量仍为W g。说明____________________________________________。
【实验结论】甲同学认为,Fe2O3粉末可以作为H2O2分解的催化剂。写出该反应的文字表达式____________________________________________。
【反思评价】乙同学认为要证明甲同学的结论正确,仅做这三个实验还不充分,需要再补充一个探究实验。该实验是__________________________________。
【拓展】下表是丙同学探究影响H2O2分解因素时所记录的部分数据,通过对数据的分析,你能得出的结论是_______________________________________________,
用足量等体积H2O2溶液制取相同体积O2所需的时间:
|
时间(min) 催化剂 | 30%H2O2溶液 | 15%H2O2溶液 | 5%H2O2溶液 |
| 加入W g MnO2 | 0.2 | 0.8 | 2.0 |
| 加入W g Fe2O3 | 7.0 | 9.0 | 16.0 |
甲同学在用双氧水制取氧气时,误把Fe2O3粉末当成MnO2放入双氧水中,发现也有大量气泡产生。他意识到这个错误后,联想到MnO2可作为H2O2分解的催化剂,那么Fe2O3能否作为H2O2分解的催化剂呢?请你一起参与探究,并填写下列空白。
【猜想】Fe2O3能作为H2O2分解的催化剂。
【实验验证】甲同学依次设计了三个实验:
实验一:取一定量的H2O2溶液于试管中,观察到有极少量气泡产生,伸入带火星的木条,没有复燃。说明H2O2溶液常温下缓慢分解。
实验二:在实验一的试管中加入W g Fe2O3粉末,有大量气泡产生,然后伸入带火星的木条,木条复燃。说明_____________________________________。
实验三:待反应结束后,将试管里的不溶物滤出,并洗涤、干燥、称量,固体质量仍为W g。说明____________________________________________。
【实验结论】甲同学认为,Fe2O3粉末可以作为H2O2分解的催化剂。写出该反应的文字表达式____________________________________________。
【反思评价】乙同学认为要证明甲同学的结论正确,仅做这三个实验还不充分,需要再补充一个探究实验。该实验是__________________________________。
【拓展】下表是丙同学探究影响H2O2分解因素时所记录的部分数据,通过对数据的分析,你能得出的结论是_______________________________________________,
用足量等体积H2O2溶液制取相同体积O2所需的时间:
|
时间(min) 催化剂 | 30%H2O2溶液 | 15%H2O2溶液 | 5%H2O2溶液 |
| 加入W g MnO2 | 0.2 | 0.8 | 2.0 |
| 加入W g Fe2O3 | 7.0 | 9.0 | 16.0 |
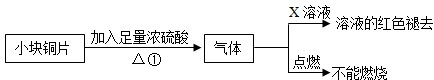
化学活动小组的同学在探究金属的化学性质时,发现铜与稀硫酸在常温时和加热的条件下均不反应,并且通过查阅资料获悉:浓硫酸与水混合会放出大量的热.那么,铜与浓硫酸能否发生反应呢?
猜想与假设:
猜想:①在常温下能反应;
②在常温下不能反应,但在加热条件下能反应;
③在加热条件下不能反应.
实验与事实:
操作:①将一小块铜片放入试管中,加入足量的浓硫酸,无明显现象;
②加热该试管,铜片上有气泡产生,并闻到刺激性气味;
③检验产生的有刺激性气味的气体(检验方法及现象均略);
④停止加热;
⑤将试管中的试液慢慢倒入少量水中,溶液呈蓝色.
结论与解释:
(1)由以上探究可知:猜想________是正确的.
(2)经检验产生的气体是SO2,停止加热是为了避免产生更多的SO2.
(3)铜跟浓硫酸在加热条件下反应的产物是SO2和CuSO4两种物质.
反思与评价:
(1)操作⑤中,从安全角度考虑(填“能”或“不能”)________将水倒入试液中.
(2)探究结论中对产物仅是SO2和CuSO4这两种物质的判断是否正确________,理由是________________.
拓展与应用:
根据以上探究和已掌握的知识,同学们又设计了两个利用废铜屑,硫酸等原料制取CuSO4的实验方案.
甲方案:利用废铜屑跟浓硫酸在加热条件下反应制取CuSO4;
乙方案:在加热条件下将废铜在空气中氧化成CuO,再将CuO与稀硫酸反应制CuSO4;请你从安全、节约、环保等方面进行评价,较好的方案是________,理由是(答出一点即可)________________.
| ||
| △ |
| ||
| △ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com