某研究性学习小组的同学在一次探究活动中,对一份纯碱样品(含有少量氯化钠)的纯度进行测定,请你参与并回答有关问题.
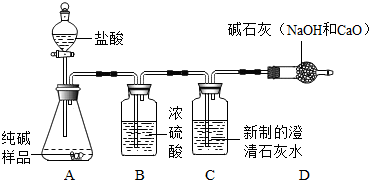
(1)甲同学进行如下操作:
①组装好如图仪器,并检查
装置的气密性
装置的气密性
;
②称取6.0g试样放入锥形瓶中,加入少量蒸馏水溶解,并在其他装置中加入相应的药品;
③称量盛有新制澄清石灰水的装置C的质量;④打开分液漏斗旋塞滴入盐酸,直到不再产生气泡为止;⑤再次称量装置C 的总质量;⑥计算出样品中碳酸钠的质量分数.
(2)上图B装置的作用是
干燥CO2气体
干燥CO2气体
; D装置的作用是
吸收空气中的CO2和H2O(水蒸气),防止它们进入C装置中,出现误差
吸收空气中的CO2和H2O(水蒸气),防止它们进入C装置中,出现误差
.
【意外发现】C瓶中石灰水没有变浑浊,同学们感到惊奇并产生了探究的欲望.
【提出猜想】原因猜想:①是生成的气体中混有盐酸挥发出来的HCl;②是生成的气体流速太快,与石灰水反应产生了可溶性物质[经查资料分析可溶性物质是Ca(HCO
3)
2,它能与酸反应生成CO
2等物质].
【实验探究】甲同学取少量实验后C瓶溶液于试管中,向其中依次滴加足量稀HNO
3和AgNO
3溶液,无气泡但有沉淀产生.据此判断只有猜想
①
①
(填“①”或“②”)成立.
【交流讨论】对于如何改进实验,乙同学认为:应将盐酸换成稀硫酸,新制的澄清石灰水换成足量NaOH溶液;丙同学认为:应在装置A和B中间插入一个盛有饱和NaHCO
3溶液的洗气装置以吸收HCl(CO
2不溶于饱和NaHCO
3溶液,也不与其反应),并将新制的澄清石灰水换成足量NaOH溶液.
大家讨论后认为:乙同学的方案可行而丙同学的方案不可行.
【请你评价】丙同学方案不可行的原因是
NaHCO3饱和溶液吸收HCl时产生CO2,导致盛有NaOH溶液的洗气瓶质量增重偏大,造成误差
NaHCO3饱和溶液吸收HCl时产生CO2,导致盛有NaOH溶液的洗气瓶质量增重偏大,造成误差
.
【教师点拨】即便换成稀硫酸和NaOH溶液,反应前后装置中存在的CO
2也会使测定出的样品纯度不准确.
【请你改进】在上述基础上,你的措施是
两次称量前,均向整套装置中鼓入经NaOH溶液洗涤过的空气,目的是排尽装置中原有空气和反应后残留的CO2,且称量时C装置两端及B装置的出口封闭
两次称量前,均向整套装置中鼓入经NaOH溶液洗涤过的空气,目的是排尽装置中原有空气和反应后残留的CO2,且称量时C装置两端及B装置的出口封闭
.
同学们仍称取6.0g试样,用改进完善后的方案重新实验.
【数据处理】装置C实验前后两次称量的质量差为2.2g,则样品的纯度为
88.3%
88.3%
.(列出计算过程)
【实验反思】若不用上述方法,而用生成沉淀的方法来测定试样中纯碱的质量分数,可选用的试剂是
BaCl2或CaCl2溶液
BaCl2或CaCl2溶液
.




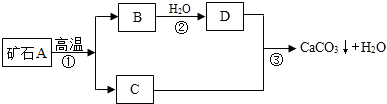
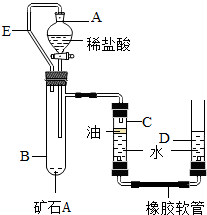 【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数.
【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数.