
题目列表(包括答案和解析)
| 实验操作 | 实验现象 | 实验结论 |
取适量滤液C于试管中,向其中通入适量二氧化碳,观察 取适量滤液C于试管中,向其中通入适量二氧化碳,观察 |
滤液变浑浊 滤液变浑浊 |
①滤液中溶质为氢氧化钙 ②猜想4成立,猜想2不成立 |
| 实验方案 | 对实验方案的评价 | |
| 方案1 | 将少量样品溶于蒸馏水后,滴入少许酚酞溶液,根据酚酞溶液是否变红,判断是否含有碳酸钠 | |
| 方案2 | 将少量样品溶于蒸馏水后,滴入少许稀盐酸溶液,根据是否产生气泡,判断是否含有碳酸钠 | |
| 方案3 | 将少量样品溶于蒸馏水后,滴入少许氯化钡溶液,根据是否产生白色沉淀,判断是否含有碳酸钠 |
| 实验方案 | 对实验方案的评价 | |
| 方案1 | 将少量样品溶于蒸馏水后,滴入少许酚酞溶液,根据酚酞溶液是否变红,判断是否含有碳酸钠 | |
| 方案2 | 将少量样品溶于蒸馏水后,滴入少许稀盐酸溶液,根据是否产生气泡,判断是否含有碳酸钠 | |
| 方案3 | 将少量样品溶于蒸馏水后,滴入少许氯化钡溶液,根据是否产生白色沉淀,判断是否含有碳酸钠 |
| 实验操作 | 实验现象 | 实验结论 |
| ______ | ______ | ①滤液中溶质为氢氧化钙 ②猜想4成立,猜想2不成立 |
实验课上,某小组的同学用生石灰进行“化学反应中能量的变化”实验时发现:向块状生石灰中加入适量水后没有明显的温度变化。为确定其原因,进行了如下实验探究。
【提出问题】生石灰是否变质?其成分是什么?
【查阅资料】氢氧化钙溶解过程中无明显温度变化,与盐酸反应无气体生成。
【猜想与假设】同学们认为生石灰样品已经变质,并对其成分作出了如下4种猜想。
猜想1:氧化钙和氢氧化钙;
猜想2:氧化钙和碳酸钙;
猜想3: ;
猜想4:氧化钙、氢氧化钙和碳酸钙。
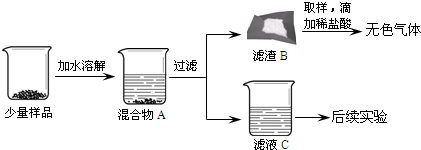
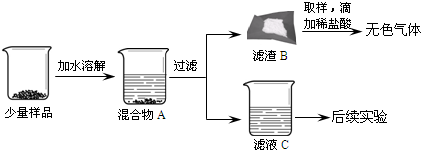
【进行实验】同学们将少量样品研碎后,按如下图所示过程进行实验。
 |
(1)在溶解过程中用温度计测量液体的温度,发现温度计示数升高,说明样品中应该含有_____。
结论:猜想3不成立。
(2)滤渣B中一定含有_____,用化学方程式表示生成该物质的反应_____。
结论:①块状生石灰表面发生变质;②猜想1不成立。
(3)为验证滤液C的成分,进行后续实验。
| 实验操作 | 实验现象 | 实验结论 |
| _____ | _____ | ①滤液中溶质为氢氧化钙 ②猜想4成立,猜想2不成立 |
【反思与评价】
上述实验过程能否得出猜想4成立、猜想2不成立的结论,理由是_____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com