实验室常用亚硫酸钠(Na
2SO
3)固体与稀硫酸在常温下反应制二氧化硫气体.二氧化硫气体是无色有刺激性气味的有毒气体,它的密度比空气大,可溶于水生成亚硫酸(H
2SO
3)
(1)试写出实验室制取二氧化硫气体的化学方程式:(特别提示:该反应与碳酸钙和稀盐酸的化学反应原理相似)
Na2SO3+H2SO4=Na2SO4+H2O+SO2↑
Na2SO3+H2SO4=Na2SO4+H2O+SO2↑
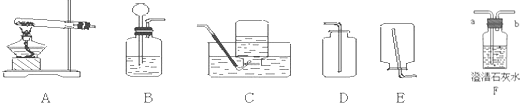
(2)制取二氧化硫时,发生装置应选用如图所示的
B
B
装置(填代号,下同);收集二氧化硫气体时,应选用下图所示
D
D
的装置.
(3)二氧化硫气体与硫化氢气体常温下混合反应,生成黄色固体硫(单质)和水.试写出此反应的化学方程式
SO2+2H2S=
SO2+2H2S=
3S↓+2H2O
3S↓+2H2O
(4)实验室若选B装置作为制取O
2和CO
2的发生装置,请分别写出制取O
2和CO
2的反应的化学方程式
、
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
.
选择B装置制取CO
2的理由是
固体与液体在常温下反应
固体与液体在常温下反应
.
(5)收集CO
2应选择
D
D
装置,检验CO
2收集满瓶的方法是
将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了
将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了
.
(6)若要检验气体是否为CO
2,应选择装置
F
F
(填序号),气体应从
a
a
(填“a”或“b”)处通入,该装置中观察到的实验现象是
澄清的石灰水变浑浊
澄清的石灰水变浑浊
反应的化学方程式是
CO2+Ca(OH)2=CaCO3↓+H2O
CO2+Ca(OH)2=CaCO3↓+H2O
.



 学习化学,我们要学会对比、归纳和小结,比如在如图所示的三个实验中,我们就能总结出一些共同点:
学习化学,我们要学会对比、归纳和小结,比如在如图所示的三个实验中,我们就能总结出一些共同点:
