
题目列表(包括答案和解析)
(12分)在25℃时,有pH为a的HCl溶液和pH为b的NaOH溶液,取Va L该HCl溶液用该NaOH溶液中和,需Vb L NaOH溶液,问:
(1)若a+b=14,则Va∶Vb=____________.
(2)若a+b=13,则Va∶Vb=______.
(3)若a+b>14,则Va∶Vb=________,且Va________Vb(填“>”“<”或“=”).
(12分)在25 ℃时,用石墨电极电解2.0 L,2.5 mol/LCuSO4溶液。5 min后,在一个石墨电极上有6.4 g Cu生成。试回答下列问题:
(1)有多少摩尔电子发生转移,得到O2的体积(标准状况)是多少升?
(2)溶液的pH是多少?
(3)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差多少?
(14分) 在25℃时,向100 mL含氯化氢14.6 g的盐酸溶液里放入5.60 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末,收集到1.12 L(标准状况)氢气。在此之后,又经过4 min,铁粉完全溶解。则:
①在前2 min内用FeCl2表示的平均反应速率是 。
②在后4 min内用HCl表示的平均反应速率是 。
③ 前2 min与后4 min相比,反应速率较快的是 ,其原因是 。
(2)已知有一组数据:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏0.5mol氧气中的O=O键需要吸收249kJ的能量;形成水分子中1 molH—O键能够释放463kJ能量。下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在下边的横线上。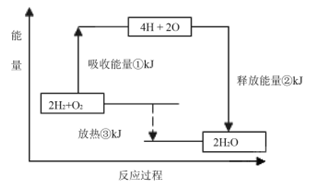
① kJ ② kJ ③ kJ
(12分)在25 ℃时,用石墨电极电解2.0 L,2.5 mol/LCuSO4溶液。5 min后,在一个石墨电极上有6.4 g Cu生成。试回答下列问题:
(1)有多少摩尔电子发生转移,得到O2的体积(标准状况)是多少升?
(2)溶液的pH是多少?
(3)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差多少?
(14分) 在25℃时,向100 mL含氯化氢14.6 g的盐酸溶液里放入5.60 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末,收集到1.12 L(标准状况)氢气。在此之后,又经过4 min,铁粉完全溶解。则:
①在前2 min内用FeCl2表示的平均反应速率是 。
②在后4 min内用HCl表示的平均反应速率是 。
③ 前2 min与后4 min相比,反应速率较快的是 ,其原因是 。
(2)已知有一组数据:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏0.5mol氧气中的O=O键需要吸收249kJ的能量;形成水分子中1 molH—O键能够释放463kJ能量。下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在下边的横线上。
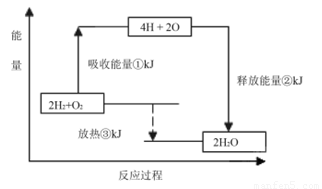
① kJ ② kJ ③ kJ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com