
题目列表(包括答案和解析)
(2009江苏盐城调研,17)已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石。有人设计了把我国的菱锰矿(MnCO3)(贫矿)转化为高品位“菱锰矿砂(MnCO3)”的绿色工艺。该工艺流程如下图所示:
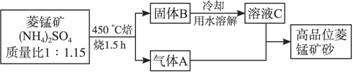
回答下列问题:
(1)气体A中含有两种气体,溶液C与气体A发生反应的化学方程式为________________。
(2)锰的化合物用途广泛,例如MnO2、KMnO4都是重要的锰化合物。MnO2可用于制备KMnO4,一般是先由MnO2在碱性条件下与O2反应制备得到K2MnO4,再由K2MnO4通过以下两种方式制备KMnO4。
方法一:电解法:2K2MnO4+2H2O![]() 2KMnO4+2KOH+H2↑
2KMnO4+2KOH+H2↑
方法二:CO2法:3K2MnO4+2CO2====2KMnO4+MnO2↓+2K2CO3
①写出MnO2得到K2MnO4的化学方程式:_______________________________。
②以上两种制备方法,方法一相对于方法二,所具有的优点是_______________________。
③KMnO4粉末在低温下与浓硫酸作用,可生成油状液体,它在0 ℃以下是稳定的,室温下会立即发生爆炸分解,分解产物为MnO2和O2,则该物质的化学式为_________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com