
题目列表(包括答案和解析)
环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:6NO3-+10Al+18H2O=3N2↑+10Al(OH)3+6OH―。又有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。
写出镁和含NO3-的废水反应的离子方程式____________________ 。
(1)环境专家认为可以用金属铝将水体中的NO![]() 转化为N2,从而消除污染.该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO
转化为N2,从而消除污染.该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO![]() 、N2,请这些粒子中除NO
、N2,请这些粒子中除NO![]() 以外的粒子填入以下空格内(不用配平).
以外的粒子填入以下空格内(不用配平).
该反应过程中,被氧化与被还原的元素的物质的量之比为________.
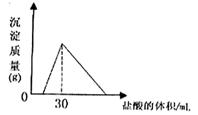
(2)将一定质量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用2 mol/L盐酸滴定,沉淀质量与消耗盐酸的体积关系如下图:

则反应过程中产生氢气的总体积为________L(标准状况下).
(1)环境专家认为可以用金属铝将水体中的NO![]() 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH![]() 、Al(OH)3、NO
、Al(OH)3、NO![]() 、N2,请将各粒子分别填入以下空格内(不用配平)。
、N2,请将各粒子分别填入以下空格内(不用配平)。
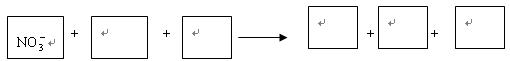
该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=
4Al(OH)3。电池正极的电极反应式为 ;正极材料采用了铂网,利用铂网为正极的优点是 。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
Fe2O3(s)+![]() C(s)=
C(s)= ![]() CO2(g)+2Fe(s) △H=234.1kJ/mol
CO2(g)+2Fe(s) △H=234.1kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:
则反应过程中产生氢气的总体积为 L(标准状况)。
(12分)(1)环境专家认为可以用金属铝将水体中的NO![]() 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH![]() 、Al(OH)3、NO
、Al(OH)3、NO![]() 、N2,请将各粒子分别填入以下空格内(不用配平)。
、N2,请将各粒子分别填入以下空格内(不用配平)。
该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=
4Al(OH)3。电池正极的电极反应式为 ;正极材料采用了铂网,利用铂网为正极的优点是 。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s) △H=234.1kJ/mol
CO2(g)+2Fe(s) △H=234.1kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:
则反应过程中产生氢气的总体积为 L(标准状况)。
(1)环境专家认为可以用金属铝将水体中的NO![]() 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH![]() 、Al(OH)3、NO
、Al(OH)3、NO![]() 、N2,请将各粒子分别填入以下空格内。
、N2,请将各粒子分别填入以下空格内。
NO3—+ + + +
该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=
4Al(OH)3。正极材料采用了铂网,利用铂网为正极的优点是 。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s) △H=+234.1kJ/mol
CO2(g)+2Fe(s) △H=+234.1kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如右图,则合金的质量为 克。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com