
题目列表(包括答案和解析)
(14分)
(1)25 ℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为
已知25 ℃时,0.1 L 0.1mol·L-1的NaA溶液的pH=10,溶液中各离子的物质的量浓度由大到小的顺序为 。
(2))若100 ℃时,KW=10-12,则100 ℃时pH=11的Ba(OH)2溶液与pH=2的硫酸按体积比1:9混合充分反应后pH= ;若该温度下10体积的pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则混合之前,a与b之间应满足的关系为 。
(3)某温度下的水溶液中,c(H+)=10x mol/L,c(OH-)=10ymol/L。x与y的关系如图所示。
该温度下水的离子积为 。该温度下氯化钠溶液的pH为
该温度下0.01 mol/L NaOH溶液的pH为 。
(14分)(1)已知:
Fe(s)+1/2O2(g)=FeO(s) ![]()
2Al(s)+3/2O2(g)= Al2O3(s) 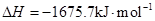
Al和FeO发生铝热反应的热化学方程式是________________________________________。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
①据图判断该反应是_____(填“吸”或“放”) 热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率__ _ _ (填“增大”、“减小”或“不变”)
②其中B历程表明此反应采用的条件为______ (选填下列序号字母)
A、升高温度 B、增大反应物的浓度
C、降低温度 D、使用了催化剂
(3) 1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+ 4H2(g) Na2S(s) + 4H2O(g) 。
①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性_______ _____
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:
①混合溶液中水电离出的c(H+)与0.1mol·L-1NaOH溶液中水电离出的c(H+)比较
(填<、>、=)。
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填<、>、=);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为 。(填序号)
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(共14分)若A~E均为单官能团有机物,它们之间有如下转化关系:
烯烃A的密度是相同条件下氧气密度的1.75倍;结构分析表明A没有顺反异构体;A的核磁共振氢谱共有两组峰,峰面积之比为1:3。B在一定条件下能与NaOH反应;E是一种有水果香气的无色液体,广泛存在于香蕉、葡萄、菠萝等水果以及啤酒花中,是一种重要的香料。
(1)D的结构简式为____________________
(2)B在一定条件下变为A的化学方程式为____________________
(3)A→C的反应类型____________________
(4) A与X互为同分异构体,它们具有相同官能团。X经过下述变化可以生成J,J能脱水缩聚成高分子化合物K。
①化合物J中官能团的名称是____________
②写出结构简式:I________________;
③由J生成K的化学方程式为____________________
④F有多种同分异构体,其中仅含有一个手性碳的结构是 。
(14分)已知A为蓝色溶液,B、C、I、K为单质,其余均为化合物。B、L、K 常温下为无色无味气体,I为有色有刺激性气味气体。G为黑色固体,F的焰色反应显紫色(透过钴玻璃观察)。反应⑤中,产物F、P的物质的量之比为1:1。各物质转化关系如下图: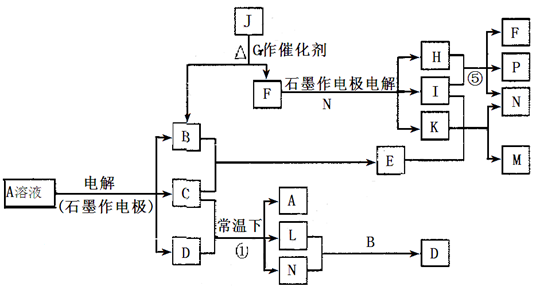
回答下列问题:
(1)P的电子式是_________;I所含元素在元素周期表中的位置是________________;
(2)写出反应①的离子方程式: ______________________________________________;
(3)M的水溶液呈___________(填“酸性”“碱性”“中性”),用离子方程式说明原因:______________________________________________________________
(4)用惰性电极电解400.00mL A溶液,一段时间后测得溶液pH=1,此时需要向溶液中加入___________,其质量为______g,才能使溶液恢复到电解前的状态(不考虑溶液体积变化)。
(14分)已知A、B、C、D、E是短周期的5种元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应;A与C同主族;B与E同主族;E的单质为黄色晶体,易溶于二硫化碳。
(1)请写出B、D元素的名称:B ,D 。
(2)画出C元素的离子结构示意图 。
(3)写出D的单质与C的最高价氧化物对应水化物之间反应的离子方程式
(4)A、B、C三种元素形成的化合物为 , 所含的化学键类型为 。
(5)B、C、D三种元素的离子半径由大到小的排列顺序为 (用离子符号表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com