
题目列表(包括答案和解析)
已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):
Cu+2H2SO4(浓)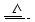 CuSO4+A↑+2H2O
CuSO4+A↑+2H2O
试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于 (用字母代号填写)
A.酸 B.碱 C.盐 D.酸性氧化物 E.碱性氧化物
A物质可以使酸性KMnO4溶液褪色,此反应中 (填写化学式,下同)失去电子,氧化剂是 。
(2)若A物质通入品红溶液,观察到溶液褪色,说明A物质具有 (填序号,下同);若A物质通入Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 。
A.氧化性 B.还原性 C.漂白性
若A物质通入双氧水,请大胆判断所得溶液是 (填溶质的化学式)
(3)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的A气体在标准状况下体积为 L (假设气体全部逸出)。若用4 mol·L-1的NaOH溶液吸收生成的A,并生成正盐,写出发生的反应方程式 计算需要NaOH溶液的体积 L。

| 实验编号 | T/℃ | 颗粒大小/μm | 干燥方式 | 实验目的 |
| 1 | 60 | 40 | 烘箱干燥 | (Ⅰ)实验1和2制得的镍催化剂,用于探究制备的干燥方式对镍催化剂损耗的影响 (Ⅱ)实验1和3制得的镍催化剂,用于探究制备的制备温度对镍催化剂损耗的影响 (Ⅲ) |
| 2 | ||||
| 3 | ||||
| 4 | 60 | 55 | 烘箱干燥 |
| 放电 |
| 充电 |
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一。其中炉渣的主要成分 是FeO、Fe2O3、SiO2、Al2O3。各物质有如下转化关系,请回答:

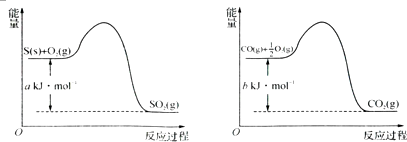
(1)写出能证明SO2具有氧化性且现象明显的化学方程式________________。
(2)用NaOH溶液吸收SO2所得NaHSO3溶液pH<7,则该溶液中存在离子的物质的量浓度由大到小的顺序是________。
(3)写出Cu2S熔炼制取粗铜的化学方程式________________________
(4)废电解液中常含有Pb2+、Zn2+,向废电解液中加入Na2S溶液,当有PbS和ZnS沉淀时,C(Zn2+): C(Pb2+)=________。[已知:Ksp(PbS)=3.4×10-28mol2·L-2、Ksp(ZnS)=1.6×10-24mol2·L-2)]
(5)写出证明溶液I中含有Fe2+的实验过程________________。
(6)Na2FeO4能杀菌净水的原因是________________。
(7)Na2FeO4和Zn可以组成碱性电池,其反应式为:3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)+4OH-。请写出放电时正极电极反应式________________。
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一。其中炉渣的主要成分 是FeO、Fe2O3、SiO2、Al2O3。各物质有如下转化关系,请回答:
(1)写出能证明SO2具有氧化性且现象明显的化学方程式________________。
(2)用NaOH溶液吸收SO2所得NaHSO3溶液pH<7,则该溶液中存在离子的物质的量浓度由大到小的顺序是________。
(3)写出Cu2S熔炼制取粗铜的化学方程式________________________
(4)废电解液中常含有Pb2+、Zn2+,向废电解液中加入Na2S溶液,当有PbS和ZnS沉淀时,C(Zn2+): C(Pb2+)=________。[已知:Ksp(PbS)=3.4×10-28mol2·L-2、Ksp(ZnS)=1.6×10-24mol2·L-2)]
(5)写出证明溶液I中含有Fe2+的实验过程________________。
(6)Na2FeO4能杀菌净水的原因是________________。
(7)Na2FeO4和Zn可以组成碱性电池,其反应式为:3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)+4OH-。请写出放电时正极电极反应式________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com