
题目列表(包括答案和解析)
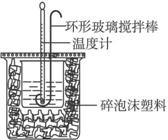
中和热的测定
(1)烧杯间填满碎泡沫塑料的作用是_______________________。
(2)大烧杯上如不盖硬纸板,求得的中和热数值_____________。(填“偏大”“偏小”或“无影响”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸进行反应,与上述实验相比,所放出的热量_____________(填“相等”“不相等”),所求中和热_____________(填“相等”“不相等”),简述理由:____________________________________________________________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_____________(填“偏大”“偏小”“无影响”)。
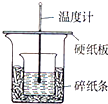 实验室利用如图装置进行中和热的测定,请回答下列问题:
实验室利用如图装置进行中和热的测定,请回答下列问题:| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |

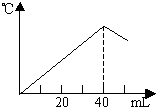 运用中和热的测定方法,在绝对保温、隔热的条件下,向20mL2.08mol/L的NaOH溶液中逐滴加入未知浓度的H2SO4(边加边充分搅拌)后,测得溶液的温度与滴加H2SO4溶液体积关系如图所示,则该H2SO4溶液的物质的量浓度约是( )
运用中和热的测定方法,在绝对保温、隔热的条件下,向20mL2.08mol/L的NaOH溶液中逐滴加入未知浓度的H2SO4(边加边充分搅拌)后,测得溶液的温度与滴加H2SO4溶液体积关系如图所示,则该H2SO4溶液的物质的量浓度约是( )| A、2.08mol/L | B、1.04mol/L | C、4.16mol/L | D、0.52mol/L |
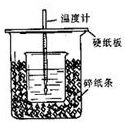
 某同学用如图装置做中和热的测定实验
某同学用如图装置做中和热的测定实验湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com