
题目列表(包括答案和解析)
| |||||||||||||||||||||||||||||||||||
过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
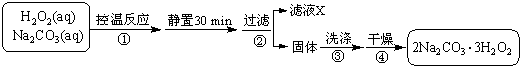 已知:主反应 2Na2CO3 (aq) + 3H2O2 (aq)
已知:主反应 2Na2CO3 (aq) + 3H2O2 (aq) ![]() 2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
副反应 2H2O2 = 2H2O + O2↑
滴定反应 6KMnO4 + 5(2Na2CO3·3H2O2) +19H2SO4 =
3K2SO4 + 6MnSO4 +10Na2SO4 + 10CO2 ↑ + 15O2↑ + 34H2O
50 °C时 2Na2CO3·3H2O2 (s) 开始分解
请回答下列问题:
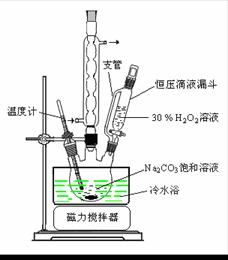
(1)图中支管的作用是 。
(2)步骤①的关键是控制温度,其措施有 、 和 。
(3)在滤液X中加入适量NaCl固体或无水乙醇, 均可析出过碳酸钠,原因是 。
(4)步骤③中选用无水乙醇洗涤产品的目的是 。
(5)下列物质中,会引起过碳酸钠分解的有 。
A.Fe2O3 B.CuO
C.Na2SiO3 D.MgSO4
(6)准确称取0.2000 g 过碳酸钠于250 mL 锥形瓶中,加50 mL 蒸馏水溶解,再加50 mL 2.0 mol·L-1 H2SO4,用2.000×10-2 mol·L-1 KMnO4 标准溶液滴定至终点时消耗30.00 mL,则产品中H2O2的质量分数为 。
(10分)下图是一个电化学过程的示意图。
请回答下列问题:
(1)图中甲池的名称 (填“原电池”“电解池”或“电镀池”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)乙池中反应的化学方程式为 ,当乙池中B极的质量增加5.4g时,甲池中理论上消耗O2的体积为 L(标准状况下),此时丙池中 电极(填“C”或“D”)析出1.6g某金属,则丙池的某盐溶液可能是 (填序号)
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液
【解析】(1)甲属于燃料电池,给乙池和丙池供电。在燃料电池中可燃物在负极通入,所以电极反应式为CH3OH+8OH――6e-=CO32-+6H2O。电极A和电池的正极相连,所以A是阳极、B是阴极、C是阳极、D是阴极。A是惰性电极,所以乙池中反应式为4AgNO3+2H2O 4Ag+O2↑+4HNO3。5.4g是单质银,转移的电子是
![]() ,所以根据得失电子守恒可知氧气的物质的量是
,所以根据得失电子守恒可知氧气的物质的量是![]() 。金属阳离子只有在阴极放电,所以在D电极放电。镁和钠属于活泼的金属,在水溶液中其离子不可能放电。1.6g若是铜,则转移的电子为
。金属阳离子只有在阴极放电,所以在D电极放电。镁和钠属于活泼的金属,在水溶液中其离子不可能放电。1.6g若是铜,则转移的电子为![]() ,正确。若是银,则说明硝酸银不足,还有氢气生成,所以答案是BD。
,正确。若是银,则说明硝酸银不足,还有氢气生成,所以答案是BD。
过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
 已知:主反应 2Na2CO3 (aq) + 3H2O2 (aq)
已知:主反应 2Na2CO3 (aq) + 3H2O2 (aq) ![]() 2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
副反应 2H2O2 = 2H2O + O2↑
滴定反应 6KMnO4 + 5(2Na2CO3·3H2O2) +19H2SO4 =
3K2SO4 + 6MnSO4 +10Na2SO4 + 10CO2 ↑ + 15O2↑ + 34H2O
 50 °C时 2Na2CO3·3H2O2 (s) 开始分解
50 °C时 2Na2CO3·3H2O2 (s) 开始分解
请回答下列问题:
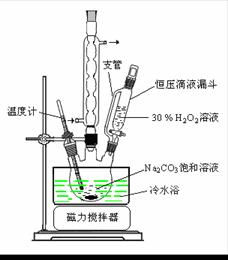
(1)图中支管的作用是 。
(2)步骤①的关键是控制温度,其措施有 、
和 。
(3)在滤液X中加入适量NaCl固体或无水乙醇,
均可析出过碳酸钠,原因是 。
(4)步骤③中选用无水乙醇洗涤产品的目的
是 。
(5)下列物质中,会引起过碳酸钠分解的有 。
A.Fe2O3 B.CuO
C.Na2SiO3 D.MgSO4
(6)准确称取0.2000 g 过碳酸钠于250 mL 锥形瓶中,加50 mL 蒸馏水溶解,再加50 mL 2.0 mol·L-1 H2SO4,用2.000×10-2 mol·L-1 KMnO4 标准溶液滴定至终点时消耗30.00 mL,则产品中H2O2的质量分数为 。
(10分)下图是一个电化学过程的示意图。

请回答下列问题:
(1)图中甲池的名称 (填“原电池”“电解池”或“电镀池”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)乙池中反应的化学方程式为 ,当乙池中B极的质量增加5.4g时,甲池中理论上消耗O2的体积为 L(标准状况下),此时丙池中 电极(填“C”或“D”)析出1.6g某金属,则丙池的某盐溶液可能是 (填序号)
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液
【解析】(1)甲属于燃料电池,给乙池和丙池供电。在燃料电池中可燃物在负极通入,所以电极反应式为CH3OH+8OH――6e-=CO32-+6H2O。电极A和电池的正极相连,所以A是阳极、B是阴极、C是阳极、D是阴极。A是惰性电极,所以乙池中反应式为4AgNO3+2H2O
 4Ag+O2↑+4HNO3。5.4g是单质银,转移的电子是
4Ag+O2↑+4HNO3。5.4g是单质银,转移的电子是 ,所以根据得失电子守恒可知氧气的物质的量是
,所以根据得失电子守恒可知氧气的物质的量是 。金属阳离子只有在阴极放电,所以在D电极放电。镁和钠属于活泼的金属,在水溶液中其离子不可能放电。1.6g若是铜,则转移的电子为
。金属阳离子只有在阴极放电,所以在D电极放电。镁和钠属于活泼的金属,在水溶液中其离子不可能放电。1.6g若是铜,则转移的电子为 ,正确。若是银,则说明硝酸银不足,还有氢气生成,所以答案是BD。
,正确。若是银,则说明硝酸银不足,还有氢气生成,所以答案是BD。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com