
题目列表(包括答案和解析)
小明和同学用稀硫酸与锌制取氢气时,发现添加少量硫酸铜溶液能加快反应。硫酸铜溶液是稀硫硫酸和锌反应的催化剂吗?硫酸铜溶液量的多少会影响反应还率吗?
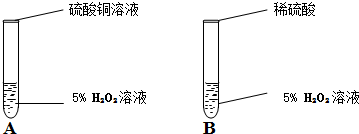
(1)他们先进行如图实验,观察到试管B中产生气泡速度快得多,并有暗红色固体生成。A实验的作用是 。他们认为CuSO4溶液不是催化剂,所依据的实验实验现象是 。
(2)在6支试管中分别加入2颗大小形状都相同的锌粒,倒入等质量、等质量分数的稀硫酸;按下表所示条件进行实验,并测量收集50毫升氢气所用的时间。记录如下:
| 试管 | A | B | C | D | E | F |
| CuSO4溶液/毫升 | 0 | 0.5 | 1 | 1.5 | 2 | 4 |
| 水/毫升 | 4 | 3.5 | 3 | V1 | V2 | 0 |
| 收集H2所用的时间/秒 | 348 | 246 | 190 | 165 | 230 | 360 |
① 试管D中加入水的体积V1==__________毫升;
② 由上表可得出,CuSO4的溶液的量对稀硫酸与锌反应速率影响的变化趋势是 。

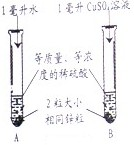 11、小明和同学用稀硫酸与锌制取氢气时,发现添加少量硫酸铜溶液能加快反应.硫酸铜溶液是稀硫硫酸和锌反应的催化剂吗?硫酸铜溶液量的多少会影响反应速率吗?
11、小明和同学用稀硫酸与锌制取氢气时,发现添加少量硫酸铜溶液能加快反应.硫酸铜溶液是稀硫硫酸和锌反应的催化剂吗?硫酸铜溶液量的多少会影响反应速率吗?| 试管 | A | B | C | D | E | F |
| CuSO4溶液/毫升 | 0 | 0.5 | 1 | 1.5 | 2 | 4 |
| 水/毫升 | 4 | 3.5 | 3 | V1 | V2 | 0 |
| 收集H2所用的时间/秒 | 348 | 246 | 190 | 165 | 230 | 360 |
| ||
| ||

| 二氧化锰 |
| 二氧化锰 |
| 加热 |
| 加热 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com