
题目列表(包括答案和解析)
(2008年北京卷,理综,27)(3)用图示装置制备NO并验证其还原性。有下列主要操作:
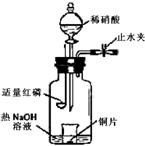 a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作是___________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是 ____________________________________________________________________。
③步骤c滴入稀硝酸后烧杯中的现象是_____________________________________
______________________________________________________________________。反应的离子方程式是____________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com