
题目列表(包括答案和解析)
氢氧化钠标准溶液因保存不当,吸收了少量的二氧化碳。若有1%的NaOH转变为 Na2CO3,以此NaOH溶液滴定未知浓度的盐酸,选用甲基橙作指示剂,盐酸浓度的测定结果会( )。
A、偏低l% B、偏高1% C、无影响 D、偏高0.1%
【解析】因为不论是氢氧化钠还是碳酸钠和盐酸反应的最终产物都是氯化钠,虽然碳酸钠还生成二氧化碳,但由于甲基橙的变色范围是3.1~4.4,所以根据钠离子守恒可知,消耗的盐酸是相同的,因此对测定结果是无影响的。答案选C
氢氧化钠标准溶液因保存不当,吸收了少量的二氧化碳。若有1%的NaOH转变为 Na2CO3,以此NaOH溶液滴定未知浓度的盐酸,选用甲基橙作指示剂,盐酸浓度的测定结果会( )。
A、偏低l% B、偏高1% C、无影响 D、偏高0.1%
【解析】因为不论是氢氧化钠还是碳酸钠和盐酸反应的最终产物都是氯化钠,虽然碳酸钠还生成二氧化碳,但由于甲基橙的变色范围是3.1~4.4,所以根据钠离子守恒可知,消耗的盐酸是相同的,因此对测定结果是无影响的。答案选C
(1)某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸。
①滴定管如图所示,用 滴定管盛装标准浓度的氢氧化钠溶液(填“甲”或“乙”)。

②用滴定的方法来测定盐酸的浓度,实验数据如下所示:
|
实验编号 |
待测HCl溶液的体积(mL) |
滴入NaOH溶液的体积(mL) |
|
1 |
20.00 |
23.00 |
|
2 |
20.00 |
23.10 |
|
3 |
20.00 |
22.90 |
该未知盐酸的浓度为(保留两位有效数字)_______________。
③下列操作会使所测得的盐酸的浓度偏低的是__________:
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数
(2)某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,设计了如下方案:称取1.0 g样品溶解于适量水中,向其中加入含AgNO3 2.38 g的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应生成沉淀的离子),Cl-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2 mol·L-1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。
请回答下列问题:
①判断滴定达到终点的现象是_______________________________________________。
②考虑Ag+和Fe3+在酸或碱性溶液中的存在形式,在实施滴定的溶液以呈_____(选填“酸性”、“中性”或“碱性”)为宜。
③在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n(Cl-)的测定结果________(选填“偏高”、“偏低”或“无影响”)。
(1)某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸。
①滴定管如图所示,用 滴定管盛装标准浓度的氢氧化钠溶液(填“甲”或“乙”)。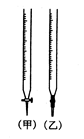
②用滴定的方法来测定盐酸的浓度,实验数据如下所示:
| 实验编号 | 待测HCl溶液的体积(mL) | 滴入NaOH溶液的体积(mL) |
| 1 | 20.00 | 23.00 |
| 2 | 20.00 | 23.10 |
| 3 | 20.00 | 22.90 |
将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为电能
C.NaOH溶液的浓度约是1.5mol/L
D.该实验表明有水生成的反应都是放热反应
【解析】温度为22℃对应的盐酸的体积是5ml,即该温度是反应后溶液的温度,因此环境温度一定低于22℃.只有当二者恰好反应时放出的热量才最多,溶液的温度才最高,根据图像可判断当盐酸的体积是30ml时温度最高,所以氢氧化钠的浓度是![]() ,该实验验证的是化学能和热能的转化,B不正确。选项D也不一定正确,所以正确的答案是C。
,该实验验证的是化学能和热能的转化,B不正确。选项D也不一定正确,所以正确的答案是C。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com