
题目列表(包括答案和解析)
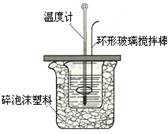 某实验小组设计用50 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在下图装置中进行中和反应。在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
某实验小组设计用50 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在下图装置中进行中和反应。在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热数值 (填偏高、偏低或不变);
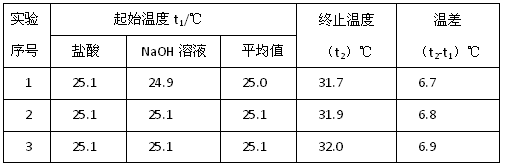
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3中和后混和液的比热容 C=4.18J(g.·℃)则该反应的中和热为△H=___________________________________;
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热的数值会 (填偏高、偏低或不变),其原因是 ;
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,试分析此操作步骤对实验测定中和热的影响 。
某实验小组设计用50 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液进行中和反应,测定中和热,中和热测定实验的关键是要比较准确地配制一定物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)中和热的测定所需的玻璃仪器有 。
(2)本实验中用稍过量的NaOH的原因是 。
(3)在反应中若因为有放热现象,而造成少量HCl挥发,则测得的中和热数值 (填偏高、偏低或不变)。
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
| 实验序号 w. | 起始温度t1/℃ w.w.^w.k.&s.5*u.c.#om | 终止温度(t2)℃[来源:学科网ZXXK][来源:学。科。网] | 温差(t2-t1)℃[来源:Z+xx+k.Com] | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 w.w.^w.k.&s.5*u.c.#om | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 w.w.^w.k.&s.5*u.c.#om | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 w.w.^w.k.&s.5*u.c.#om | 31.9 w.w.^w.k.&s.5*u.c.#om | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混和液的比热容 C=4.18J/(g·℃)则该反应的中和热为△H=_______________________________。
(5)若用等浓度的醋酸代替盐酸与NaOH溶液反应,则测得的中和热的数值会 (填偏高、偏低或不变),其原因 ![]() 。
。
 ℃),则该反应的中和热为△H=__________________(结果保留一位小数)。
℃),则该反应的中和热为△H=__________________(结果保留一位小数)。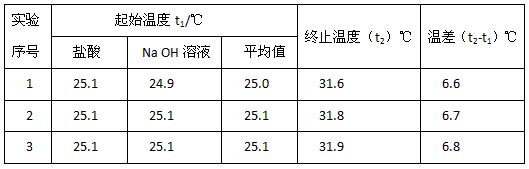
某实验小组设计用50 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液进行中和反应,测定中和热,中和热测定实验的关键是要比较准确地配制一定物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)中和热的测定所需的玻璃仪器有
(2)本实验中用稍过量的NaOH的原因是 。
(3)在反应中若因为有放热现象,而造成少量HCl挥发,则测得的中和热数值 (填偏高、偏低或不变);
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
实验序号 w. | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混和液的比热容 C=4.18J/(g·℃)则该反应的中和热为△H=_______________________________;
(5)若用等浓度的醋酸代替盐酸与NaOH溶液反应,则测得的中和热的数值会 (填偏高、偏低或不变),其原因 ;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com