
题目列表(包括答案和解析)
(16分) 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)? ?2SO3(g) ΔH=-190kJ·mol-1
?2SO3(g) ΔH=-190kJ·mol-1
(1)该热化学反应方程式的意义是_______________________________________________
升高温度上述反应平衡常数____(填“变大”“变小”或“不变”)。
(2)下列描述中能说明上述反应已达平衡的是________。
a.v(O2)正=2v(SO3)逆
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(3)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2)=__________mol·L-1·min-1;若继续通入0.20 mol SO2和0.10 mol O2,则平衡________________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(SO3)<________mol。
(16分)在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)  2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)写出该反应的化学平衡常数表达式K=__________。
(2)降低温度,该反应K值______,二氧化硫转化率______,化学反应速率______。(以上均填“增大”“减小”或“不变”)
(3)600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是________。
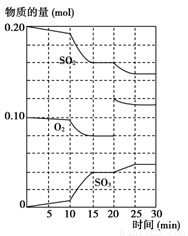
(4)据上图判断,反应进行至20 min时,曲线发生变化的原因是________________ __________________________(用文字表达);10 min到15 min的曲线变化的原因可能是________(填写编号)。
a.加了催化剂
b.缩小容器体积
c.降低温度
d.增加SO3的物质的量
(16分) 硫—碘循环分解水制氢主要涉及下列反应:
I SO2+2H2O+I2==H2SO4+2HI
II 2HI  H2+I2
H2+I2
III 2H2SO4==2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应III易在常温下进行
b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1molO2的同时产生1 molH2
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)= 。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知 2H2(g)+O2(g)====2H2O(l) △H=-572kJ·mol-1
某氢氧燃料电池释放22.8kJ电能时,生成1mol液态水,该电池的能量转化率为 。
(16分) 硫—碘循环分解水制氢主要涉及下列反应:
I SO2+2H2O+I2==H2SO4+2HI
II 2HI  H2+I2
H2+I2
III 2H2SO4==2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应III易在常温下进行
b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1molO2的同时产生1 molH2
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)=
。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则
是原来的2倍。
2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则
是原来的2倍。

a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知 2H2(g)+O2(g)====2H2O(l) △H=-572kJ·mol-1
某氢氧燃料电池释放22.8kJ电能时,生成1mol液态水,该电池的能量转化率为 。
(16分) 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)? ?2SO3(g) ΔH=-190kJ·mol-1
?2SO3(g) ΔH=-190kJ·mol-1
(1)该热化学反应方程式的意义是_______________________________________________
升高温度上述反应平衡常数____(填“变大”“变小”或“不变”)。
(2)下列描述中能说明上述反应已达平衡的是________。
a.v(O2)正=2v(SO3)逆
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(3)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2)=__________mol·L-1·min-1;若继续通入0.20 mol SO2和0.10 mol O2,则平衡________________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(SO3)<________mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com