
题目列表(包括答案和解析)
(1)下列说法不正确的是________(填字母序号)。
| A.60周年国庆阅兵车HQE顶级红旗采用全铝车身,铝的氧化物属于碱性氧化物 |
| B.用热的纯碱溶液洗涤沾有油污的器具时发生的主要是化学变化 |
| C.英国华裔科学家高锟因在“光在纤维中的传输应用于光学通信方面”做出了突破性成就,而获得了2009年诺贝尔物理学奖,光纤制品的基本原料为SiO2 |
| D.液氨、液氯、液态氯化氢都是非电解质 |
下列说法:
![]() (1)在一定条件下,可逆反应(也是放热反应)N2+3H2
(1)在一定条件下,可逆反应(也是放热反应)N2+3H2![]() 2NH3能够发生,某容器内充入一定量的N2和H2,当单独改变某个条件时:
2NH3能够发生,某容器内充入一定量的N2和H2,当单独改变某个条件时:
![]() ①加催化剂,v(正)、v(逆)都发生变化,且变化倍数相等
①加催化剂,v(正)、v(逆)都发生变化,且变化倍数相等
![]() ②加压,v(正)、v(逆)都增大
②加压,v(正)、v(逆)都增大
![]() ③降温,v(正)、v(逆)都减小,且v(正)减小倍数一定大于v(逆)减小倍数
③降温,v(正)、v(逆)都减小,且v(正)减小倍数一定大于v(逆)减小倍数
![]() ④增加N2的浓度,v(正)、v(逆)都增大
④增加N2的浓度,v(正)、v(逆)都增大
![]() (2)NO和CO都是汽车尾气里的有害气体,它们能缓慢起反应生成N2和CO2.对此:
(2)NO和CO都是汽车尾气里的有害气体,它们能缓慢起反应生成N2和CO2.对此:
![]() ⑤使用催化剂不改变化学反应速率 ⑥升高温度能加快化学反应速率
⑤使用催化剂不改变化学反应速率 ⑥升高温度能加快化学反应速率
![]() ⑦降低压强能加快化学反应速率 ⑧改变压强对化学反应速率无影响
⑦降低压强能加快化学反应速率 ⑧改变压强对化学反应速率无影响
![]() (3)下列说法中:
(3)下列说法中:
![]() ⑨一定条件下增大反应物的量,会加快化学反应速率
⑨一定条件下增大反应物的量,会加快化学反应速率
![]() ⑩升高温度对放热反应会减慢反应速率,对吸热反应会加快反应速率
⑩升高温度对放热反应会减慢反应速率,对吸热反应会加快反应速率
![]() 11加大压强一定会加快反应速率
11加大压强一定会加快反应速率
![]() 12使用催化剂降低反应的活化能,所以会加快反应速率
12使用催化剂降低反应的活化能,所以会加快反应速率
![]() 正确组合是 ( )
正确组合是 ( )
![]() A.①②④⑥12 B.②③⑤⑦⑨ C.④⑤⑨⑩12 D.全部
A.①②④⑥12 B.②③⑤⑦⑨ C.④⑤⑨⑩12 D.全部
 CH3OH(g)过程中 能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入amol CO、2amol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
CH3OH(g)过程中 能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入amol CO、2amol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。 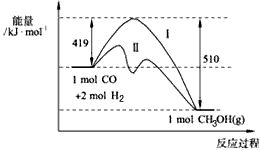
 CH3OH(g) ΔH>-91 kJ·mol-1
CH3OH(g) ΔH>-91 kJ·mol-1 
(3)氧化还原反应中实际上包含氧化和还原两个过程。下面是HNO3发生的一个还原过程的反应式:
NO3-+4H++3e-→NO+2H2O
① KMnO4、Na2CO3、CuO、KI四种物质中的______________(填化学式)能使上述还原过程发生。
②欲用上图II装置通过测定气体生成量测算硝酸被还原的速率,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测定_________________________推算反应速率。
下列是元素周期表的一部分,有关说法不正确的是 ( )
|
A.a、b、d、f四种元素的离子半径:f>d>a>b
B.元素b的单质不能与酸性氧化物发生化学反应
C.元素c的氧化物既能与酸反应,又能与碱反应
D.a、c、e的最高价氧化物对应的水化物之间能够相互反应
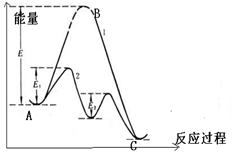
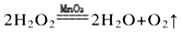 ΔH>0 ,该反应过程可用该图象表示
ΔH>0 ,该反应过程可用该图象表示 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com