(2012?奉贤区二模)研究NO
2、NO、SO
2、CO等大气污染气体的处理具有重要意义.
(1)NO
2可用水吸收,相应的化学反应方程式为
3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
.利用反应6NO
2(g)+8NH
3(g)
7N
2(g)+12H
2O(g)也可处理NO
2.则化学平衡常数表达式K=
| C7(N2)C12(H2O) |
| C6(NO2)C8(NH3) |
| C7(N2)C12(H2O) |
| C6(NO2)C8(NH3) |
;当转移1.2mol电子时,消耗的NO
2在标准状况下是
6.72
6.72
L.
(2)汽车尾气中含有NO和CO气体,对环境有影响.已知平衡常数K的值大小,是衡量化学反应进行程度的标志.在25℃时,下列反应及平衡常数如下
2NO(g)?N
2(g)+O
2(g)-Q
1 K
1=1×10
302CO(g)+O
2(g)?2CO
2(g)+Q
2 K
2=2.5×10
91为了完成汽车尾气处理装置的改造,除去氮氧化物、一氧化碳污染气体,根据上述有关数据判断,下列说法正确的是
C
C
A.改造后的尾气装置使用高温高压,可大量减少污染气体的排放
B.汽车尾气中氮氧化物在空气中会自动的转化为氮肥,对植物生长有益,可不必除去
C.改造后的尾气装置使用催化剂,可大量减少污染气体的排放
D.根据K
1和K
2的数据,尾气中NO和CO可自行转化为无害气体
(3)一定条件下将CO和H
2O发生反应,可减少CO对环境的影响.若在700℃时,向容积为2L的密闭容器中充入一定量的CO和H
2O,发生反应:CO(g)+H
2O(g)?CO
2+H
2(g)
反应过程中测定的部分数据见下表(表中t
1<t
2):
| 反应时间/min |
n(CO)/mol |
H2O/mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
|
0.20 |
反应在t
1min内的平均速率为v(H
2)=
mol?L
-1?min
-1,保持其他条件不变,起始时向容器中充入2.40molCO和1.20molH
2O,到达平衡时,n(CO
2)
等于
等于
0.80mol(填:大于、小于、等于).
(4)酸雨是大气污染的危害之一,二氧化硫(SO
2)的含量是空气质量监测的一个重要指标.某兴趣小组同学收集某地的雨水进行实验,每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
| 测定时间/h |
0 |
1 |
2 |
3 |
4 |
| 雨水样品的pH |
4.73 |
4.62 |
4.56 |
4.55 |
4.55 |
请写出上述PH变化的原因(用化学方程式表示)
2H2SO3+O2=2H2SO4
2H2SO3+O2=2H2SO4
.

 7N2(g)+12H2O(g)也可处理NO2。则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是_______L。
7N2(g)+12H2O(g)也可处理NO2。则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是_______L。 
 CO2+H2(g) 反应过程中测定的部分数据见下表(表中t1>t2)
CO2+H2(g) 反应过程中测定的部分数据见下表(表中t1>t2) 

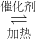 7N2(g)+12H2O(g)也可处理NO2.则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是______L.
7N2(g)+12H2O(g)也可处理NO2.则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是______L.