
BaSO
4在水中存在沉淀溶解平衡BaSO
4(s)═Ba
2+(aq)+SO
42-(aq),溶度积常数K
sp=c(Ba
2+)?c(SO
42-).
(1)某温度时,BaSO
4的沉淀溶解平衡曲线如图所示.
下列说法正确的是
C
C
A.加入Na
2SO
4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO
4沉淀生成
D.a点对应的K
sp大于c点对应的K
sp(2)在胃部透视时,服用的“钡餐”的主要成分是硫酸钡.在25℃时,硫酸钡的溶度积常数约为1.21×10
-10.
①Ba
2+是一种有毒的重金属离子,当人体中c(Ba
2+)达到2×10
-3mol?L
-1时,就会对健康产生危害.硫酸钡作为“钡餐”的理由
c(Ba2+)=1.1×10-5mol?L-1<2×10-3 mol?L-1,胃液中H+ 对BaSO4的沉淀溶解平衡没有影响,因此BaSO4可用做“钡餐”
c(Ba2+)=1.1×10-5mol?L-1<2×10-3 mol?L-1,胃液中H+ 对BaSO4的沉淀溶解平衡没有影响,因此BaSO4可用做“钡餐”
.
②在25℃时,1L水中约能溶解0.0197g 碳酸钡,且胃液是酸性的,
不能
不能
(能/不能)用碳酸钡代替硫酸钡作为“钡餐”,理由是
BaCO3(s)?Ba2+(aq)+CO32-(aq),尽管c(Ba2+)=1.0×10-4mol?L-1<2×10-3 mol?L-1,但由于胃液是酸性的,胃酸可与CO32-反应生成二氧化碳和水,使CO32-的浓度降低,使BaCO3的沉淀溶解平衡向右移动,使Ba2+浓度增大而引起人体中毒.
BaCO3(s)?Ba2+(aq)+CO32-(aq),尽管c(Ba2+)=1.0×10-4mol?L-1<2×10-3 mol?L-1,但由于胃液是酸性的,胃酸可与CO32-反应生成二氧化碳和水,使CO32-的浓度降低,使BaCO3的沉淀溶解平衡向右移动,使Ba2+浓度增大而引起人体中毒.
.

 BaSO4在水中存在沉淀溶解平衡BaSO4(s)═Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)?c(SO42-).
BaSO4在水中存在沉淀溶解平衡BaSO4(s)═Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)?c(SO42-).



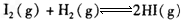 在一定条件下已达到化学平衡状态。由于改变一个条件,达到新平衡时,可能引起下列变化,这些变化中能说明平衡一定向正反应方向移动的是
在一定条件下已达到化学平衡状态。由于改变一个条件,达到新平衡时,可能引起下列变化,这些变化中能说明平衡一定向正反应方向移动的是