
题目列表(包括答案和解析)
(1)此时溶液的溶质如果是单一成分,可能是________________,如果是多种成分,可能是_______________。
(2)在上述所得溶液中,逐滴缓慢滴加1 mol·L -1的盐酸,所得气体(不考虑溶解于水)的体积与所加的盐酸的体积关系如下图所示:
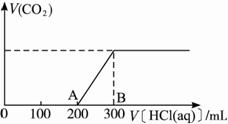
①加入盐酸200 mL之前,无气体产生,写出OA段发生反应的离子方程式__________________。
②产生的CO2在标准状况下的体积为_____________mL。
③B点时,反应所得溶液中溶质的物质的量浓度是 ______________mol·L -1(溶液体积的变化忽略不计)。
(1)此时溶液的溶质如果是单一成分,可能是____________,如果是多种成分,可能是____________。
(2)在上述所得的溶液中,逐滴缓慢滴加盐酸 1 mol·L-1,所得气体(不考虑溶解于水)的体积与所加的盐酸的体积关系如下图所示:
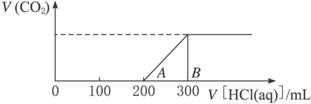
①加入200 mL 盐酸之前,无气体产生,写出A点之前发生反应的离子方程式___________________________________。
②求产生的二氧化碳在标准状况下的体积多少。
③求B点时,反应所得溶液中溶质的物质的量浓度是多少。(溶液体积的变化忽略不计)。
向100 mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应后,测得最后溶液的PH>7。
(1)由下图分析,最后溶液中的溶质为 物质的量分别为 moL moL

(2)在上述所得溶液中,逐滴缓慢滴加1mol/L的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示:
① 加入盐酸200mL之前,无气体产生,写出OA段发生反应的离子方程式:
、
② 产生的CO2气体的最大体积在标况下的体积为 mL
③B点时,反应所得溶液中溶质的物质的量浓度是 mol/L
(体积的变化忽略不计)
向100 mL 3 mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应后,测得最后溶液的PH>7.
(1)由下图分析,最后溶液中的溶质为________ ________物质的量分别为________moL________moL
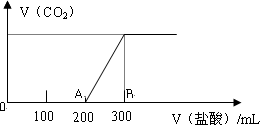
(2)在上述所得溶液中,逐滴缓慢滴加1 mol/L的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示:
①加入盐酸200 mL之前,无气体产生,写出OA段发生反应的离子方程式:
________、________
②产生的CO2气体的最大体积在标况下的体积为________mL
③B点时,反应所得溶液中溶质的物质的量浓度是________mol/L(体积的变化忽略不计)


| ||
| ||
| 168Q |
| m |
| 168Q |
| m |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com