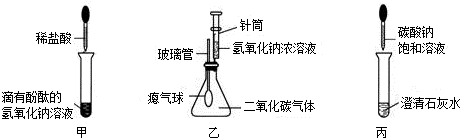
33、某化学兴趣小组,在学习碱的化学性质时,进行了如图所示的实验.
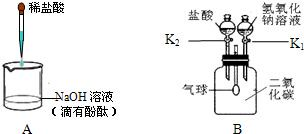
(1) 写出A实验中盐酸和氢氧化钠反应的化学方程式
NaOH+HCl═NaCl+H2O
.
(2) B实验用于确认二氧化碳与氢氧化钠能发生化学反应(实验前K
1、K
2均处于关闭状态).请写出实验中K
2处于关闭状态下打开K
1时发生反应的化学反应方程式
2NaOH+CO2═Na2CO3+H2O
;B实验全过程观察到的现象
打开K1时观察到气球鼓起,打开K2时观察到有气泡生成且气球变小
.
(3)实验结束后,同学们将A、B两个实验的废液倒入同一个烧杯中,观察到液体呈红色,由此产生疑问.

(提出问题)烧杯的废液中含有哪些物质?
(交流讨论)一定含有的物质:酚酞、水和
NaCl
,还含有能使酚酞变红的物质.同学们猜想能使酚酞变红的物质是什么?
(查阅资料)碳酸钠溶液呈碱性,氯化钙溶液呈中性,CaCl
2+Na
2CO
3=CaCO
3↓+2NaCl
(猜 想)废液中能使酚酞变红的物质是:
A.只有氢氧化钠 B.只有碳酸钠 C.
碳酸钠和氢氧化钠
(设计实验)兴趣小组的同学用氯化钙溶液来验证猜想.
(实验验证)同学们对废液中还可能含有的物质进行确定:取一定量的废液,逐滴加入氯化钙溶液.
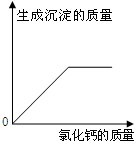
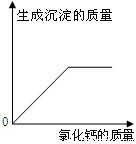
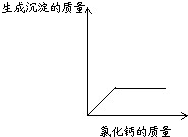
(结论解释)通过实验,同学们得出了确切的结论.(下图为同学们根据部分实验现象绘制的关系曲线).

猜想中一定不成立的是
A
(填序号)
(表达与交流)请你分析他们能得出确切结论的理由
据图可知,加入氯化钙溶液就有沉淀生成,废液中一定含有碳酸钠.若加入过量氯化钙溶液废液红色褪去则不含氢氧化钠,若仍呈红色则含氢氧化钠.
.

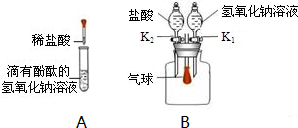

 18、某化学兴趣小组,在学习碱的化学性质时,进行了如图所示的实验.
18、某化学兴趣小组,在学习碱的化学性质时,进行了如图所示的实验.