
题目列表(包括答案和解析)

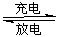 Li+LiFeSiO4,该电池放电时,负极是________,正极反应式为__________________。
Li+LiFeSiO4,该电池放电时,负极是________,正极反应式为__________________。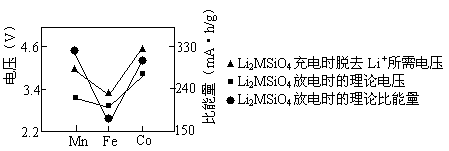

 Li+LiFeSiO4,该电池放电时,负极是________,正极反应式为__________________。
Li+LiFeSiO4,该电池放电时,负极是________,正极反应式为__________________。
(16分)(1)铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O根据上述情况判断
①蓄电池的负极电极反应式为__ ____。②蓄电池工作时,其中正极附近溶液的pH______(增大、减小、不变)。③实验室用铅蓄电池作电源电解饱和食盐水制取氯气,今若制得Cl20.050mol,这时电池内消耗的H2SO4的物质的量至少是 。
(2)镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
①该电池充电时阳极反应式:
②放电时负极附近溶液的碱性 (填“增强”或“减弱”或“不变”)
(3) Zn—MnO2干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl混合溶液。
①该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
②若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。
③MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 g。
(14分)
Ⅰ.有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入2 mol/LH2SO4溶液中,乙同学将电极放入2 mol/L的NaOH溶液中,如图:
(1)写出甲池中正极的电极反应式: ;
(2)写出乙池中负极的电极反应式: ;
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出 活动性更强(填元素符号)。
(4)由此实验,可得到如下哪些正确结论?( )
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的电解质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动顺序表已过时,已设有实用价值 |
| D.该实验说明化学研究对象复杂、化学反应受条件影响较大,因此应具体问题具体分析 |
 xC(g) + D(g),反应达到平衡时C的浓度为1.2 mol/L,B的浓度为0.1 mol/L。
xC(g) + D(g),反应达到平衡时C的浓度为1.2 mol/L,B的浓度为0.1 mol/L。(14分)
Ⅰ.有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入2 mol/L H2SO4溶液中,乙同学将电极放入2 mol/L的NaOH溶液中,如图:

(1)写出甲池中正极的电极反应式: ;
(2)写出乙池中负极的电极反应式: ;
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出 活动性更强(填元素符号)。
(4)由此实验,可得到如下哪些正确结论?( )
A.利用原电池反应判断金属活动性顺序时应注意选择合适的电解质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序表已过时,已设有实用价值
D.该实验说明化学研究对象复杂、化学反应受条件影响较大,因此应具体问题具体分析
Ⅱ.向一个容积为2 L的密闭容器中充入2 mol A和1
mol B,发生如下反应:2 A(g)
+ B(g)  xC(g) + D(g),反应达到平衡时C的浓度为1.2 mol/L,B的浓度为0.1 mol/L。
xC(g) + D(g),反应达到平衡时C的浓度为1.2 mol/L,B的浓度为0.1 mol/L。
(1)x= ;
(2)若使容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为
(填“吸热”或“放热”)反应;
(3)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是 (用序号填空)
①4 mol A + 2 mol B
②3 mol C + 1 mol D
③3 mol C + 1 mol D +1 mol B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com